
 “C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.
“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义.| 容器 编号 | 温度(℃) | 起始的物质的量(mol) | 平衡的物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| 物质 | CO2 | H2 | CH3OH | H2O |
| 起始投料/mol | 1 | 3 | 2 | 0 |
分析 (1)①根据v=$\frac{△c}{△t}$进行计算求解;
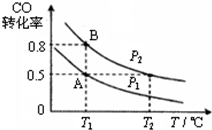
②增大压强,平衡正向移动,一氧化碳的转化率增大;
(2)①温度越高,反应速率越大,反应时间越短;
②该反应是反应前后气体体积不变的反应,温度相同,化学平衡常数相同,反应物的转化率相同;
③根据化学平衡常数与浓度商的相对大小判断反应方向,如果浓度商小于平衡常数,则平衡向正反应方向进行;
(3)根据压强和温度对化学反应平衡移动的影响因素结合化学平衡常数计算公式解答,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)正反应是一个体积缩小的反应,反应在恒容绝热的情况下,从正反应开始,反应达到平衡后,体系压强升高,可推知体系的温度升高,说明正反应为放热反应.
解答 解:(1)①v=$\frac{△c}{△t}$=$\frac{\frac{2mol×0.5}{2L}}{ts}$=$\frac{0.5}{t}$mol•L-1•s-1,故答案为:$\frac{0.5}{t}$mol•L-1•s-1;
②温度相同p2对应的一氧化碳的转化率大,所以压强p1<压强p2,故答案为:<;
(2)①容器Ⅰ中的温度比容器III的温度高,温度越高反应速率越快,达到平衡所需时间越短,故答案为:短;
②恒容条件下,容器Ⅱ相当于在容器Ⅰ的基础上加压,但由于该反应是反应前后气体体积不变的反应,因此平衡不移动,所以容器Ⅰ中的CH3OH体积分数和容器Ⅱ中的相等,故答案为:相等;
③c(CH3OH)=0.1mol/L、c(CH3OCH3 )=0.15mol/L、c(H2O)=0.10mol/L,浓度商=$\frac{0.1×0.15}{0.1×0.1}$=1.5<4,平衡向正反应方向移动,故答案为:正反应;
(3)根据压强和温度对化学反应平衡移动的影响因素结合化学平衡常数计算公式解答,CO2(g)+3H2(g)?CH3OH(g)+H2O(g)正反应是一个体积缩小的反应,反应在恒容绝热的情况下,从正反应开始,反应达到平衡后,体系压强升高,可推知体系的温度升高,说明正反应为放热反应,所以升高温度平衡常数减小,故答案为:减小.
点评 本题考查了化学平衡常数的有关计算,根据平衡常数公式计算平衡常数,再结合浓度与反应速率的关系、化学平衡常数与浓度商之间的关系来分析解答,注意该反应特点,题目难度中等.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应A(s)?2B(g)+C(g),当C的体积分数不变时,反应达到平衡状态 | |
| B. | 将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 | |
| C. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)═HgS(s)+Fe2+(aq) | |
| D. | 增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,平衡常数将增大 | |
| B. | 达到平衡时,单位时间里消耗n mol S2Cl2的同时也生成n molCl2 | |
| C. | 达到平衡时,若升高温度,氯气的百分含量减小 | |
| D. | 加入氯气,平衡向正反应方向移动,氯气的转化率一定升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体颜色变深 | B. | 气体颜色不变 | C. | 气体颜色变浅 | D. | 先变深后变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅是良好的半导体材料 | |
| B. | 硅酸比碳酸酸性弱,故二氧化硅不能与碳酸钠反应 | |
| C. | 氢氟酸可以用来雕刻玻璃 | |
| D. | 玻璃、水泥、陶瓷都属于硅酸盐产品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com