
| A. | 乙醇的结构简式为C2H6O | |
| B. | C3H6Cl2有5种同分异构体 | |
| C. | 乙酸溶于水可以电离,属于离子化合物 | |
| D. | 由苯乙烯生成聚苯乙烯塑料属于加聚反应 |
分析 A.有机物的结构简式必须表示出官能团;
B.C3H6Cl2可以看作C3H8分子中2个H原子被2个Cl取代产物,2个Cl原子可以取代同一C原子上的两个氢原子,也可以取代不同C原子上的H原子,据此根据有机物烷烃的同分异构体的写法来书写其所有的同分异构体;
C.乙酸是共价化合物;
D.苯乙烯中含有碳碳双键,所以能发生加聚反应.
解答 解:A.有机物的结构简式必须表示出官能团,则乙醇的结构简式为:C2H5OH,故A错误;
B.分子式为C3H6Cl2的有机物可以看作C3H8中的两个氢原子被两个氯原子取代,碳链上的3个碳中,两个氯原子取代一个碳上的氢原子,有2种:CH3-CH2-CHCl2 (甲基上的氢原子时一样)、CH3-CCl2 -CH3,分别取代两个碳上的氢,有2种:CH2Cl-CH2-CH2Cl(两个边上的),CH2Cl-CHCl-CH3 (一中间一边上),共有4种,故B错误;
C.电离与化合物的类别没有关系,乙酸为共价化合物,溶于水电离产生离子,故C错误;
D.苯乙烯中含有碳碳双键,所以能发生加聚反应生成聚苯乙烯,故D正确;
故选D.
点评 本题主要考查有机物结构和性质,明确官能团与性质关系、同分异构体的书写方法即可解答,侧重考查基本概念,题目难度不大.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:实验题
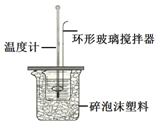 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| HCl | NaOH | ||
| 1 | 26.1 | 26.1 | 29.3 |
| 2 | 25.9 | 25.9 | 29.0 |
| 3 | 26.3 | 26.3 | 29.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨可用作制冷剂是因为其气化时可放出大量的热 | |
| B. | 将青蒿在乙醚中浸取,通过分馏可提取治疗疟疾的青蒿素 | |
| C. | 钢制品、铝制品在日常生活中被广泛应用是因为铁、铝为活泼金属 | |
| D. | 久置的漂白粉变质是因为漂白粉与空气中的O2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl可用作食品调味剂 | |
| B. | 相同温度下NaHCO3溶解度大于Na2CO3 | |
| C. | Na2CO3的焰色反应呈黄色 | |
| D. | 工业上Na可用于制备钛、锆等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46 gNO2与N2O4的混合气体中含有的分子总数为NA | |
| B. | 常温常压下,将0.1molFe投人足量的浓硝酸中,转移的电子数为0.3NA | |
| C. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| D. | 0.1mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学性质 | 实际应用 |
| A | ClO2具有强氧化性 | 自来水消毒杀菌 |
| B | SO2具有还原性 | 用作漂白剂 |
| C | NaHCO3受热易分解并且生成气体 | 焙制糕点 |
| D | Al(OH)3分解吸收大量热量并有H2O生成 | 阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
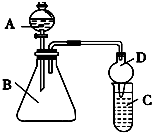 某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 0.60 | 0.30 |
| t1 | 0.40 | |
| t2 | 0.10 |
| A. | 反应在t1min内的平均速率为v(H2)=0.20/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.10molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| C. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| D. | 700℃时,若向密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为0.60mol、1.00mol、0.60mol、0.60mol,则此时该反应v(正)<v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com