

| A、反应①②是加成反应,其它所标明的反应都是取代反应 |
| B、上述物质中能与NaOH溶液反应的只有乙酸 |
| C、等物质的量的乙烯和乙醇与足量氧气反应时耗氧量相同 |
| D、1,2-二溴乙烷、乙烯、乙醇烃基上的氢被氯取代,其一氯取代产物都是一种 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氢氧化钠溶液吸收少量二氧化硫:2OH-+SO2═SO32-+H2O |
| B、金属铝溶于盐酸中:Al+2H+═Al3++H2↑ |
| C、硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| D、碳酸镁溶于硝酸中:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
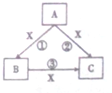 在化学反应中,反应物相同时,因反应条件不同或反应物的量不同产物可能不同,已知A,B,C,X均为中学化学中的常见物质,在常温下它们有如图转化关系(部分产物已略去)回答下列问题
在化学反应中,反应物相同时,因反应条件不同或反应物的量不同产物可能不同,已知A,B,C,X均为中学化学中的常见物质,在常温下它们有如图转化关系(部分产物已略去)回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
| hv |
| hv |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.该厂污水处理设计装置如图所示,下列说法正确的是( )
某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.该厂污水处理设计装置如图所示,下列说法正确的是( )| A、通入空气的电极为阳极 |
| B、甲装置中Fe电极的反应为Fe-3e-═Fe3+ |
| C、为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环物质为CO2 |
| D、当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为8.96 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com