
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
表示下列变化的化学用语正确的是
A.溴化亚铁溶液中通入过量氯气:2Fe2++2Br-+3Cl2==2Fe3++Br2+6Cl-
B.实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)![]() Mn2++Cl2↑+2Cl-+2H2O C.用FeS除去工业废水中含有的Cu2+:S2-(aq)+Cu2+(aq)=CuS(s)↓
Mn2++Cl2↑+2Cl-+2H2O C.用FeS除去工业废水中含有的Cu2+:S2-(aq)+Cu2+(aq)=CuS(s)↓
D.1L0.5mol·L-1稀硫酸与1L 1mol·L-1氢氧化钠溶液反应放出57.3kJ的热量:
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2010年山东青岛市高三第二次模拟练习 题型:填空题
(15分)
(1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下: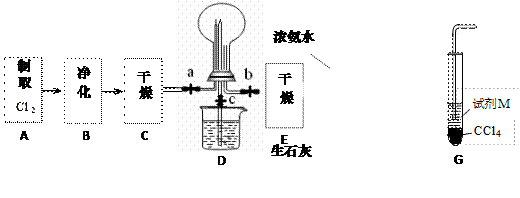
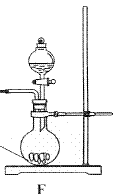
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2 的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管)。请回答A中发生反应的离子方程式 ,试剂M为 溶液,证明氧化性为Cl2>Fe3+>I2的 实验现象是 ;
②已知3Cl2 +2 NH3 =" 6HCl" + N2 ,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b ,D中的现象为 ,反应一段时间后,关闭b打开c,观察到的现象为 ;
③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法 ;
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案: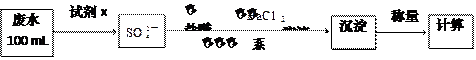
①从下列试剂中选择试剂x为 (填序号):
A.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液 B.0.5 mol·L-1 1NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂x生成SO42-的离子方程式为 ;
③第ⅲ步的“系列操作”包含的操作名称为 、 、 ;
④证明该废水中是否含有CO32-的实验方案为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下:
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2 的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管)。请回答A中发生反应的离子方程式 ,试剂M为 溶液,证明氧化性为Cl2>Fe3+>I2的 实验现象是 ;
②已知3Cl2 +2 NH3 = 6HCl + N2 ,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b ,D中的现象为 ,反应一段时间后,关闭b打开c,观察到的现象为 ;
③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法 ;
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案:
①从下列试剂中选择试剂x为 (填序号):
A.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液 B.0.5 mol·L-1 1NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂x生成SO42-的离子方程式为 ;
③第ⅲ步的“系列操作”包含的操作名称为 、 、 ;
④证明该废水中是否含有CO32-的实验方案为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下:
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2 的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管)。请回答A中发生反应的离子方程式 ,试剂M为 溶液,证明氧化性为Cl2>Fe3+>I2的 实验现象是 ;
②已知3Cl2 +2 NH3 = 6HCl + N2 ,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b ,D中的现象为 ,反应一段时间后,关闭b打开c,观察到的现象为 ;
③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法 ;
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案:
①从下列试剂中选择试剂x为 (填序号):
A.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液 B.0.5 mol·L-1 1NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂x生成SO42-的离子方程式为 ;
③第ⅲ步的“系列操作”包含的操作名称为 、 、 ;
④证明该废水中是否含有CO32-的实验方案为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A、溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2—→2Fe3++2Br2+6Cl-
B、实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)![]() Mn2++Cl2↑+2Cl-+2H2O
Mn2++Cl2↑+2Cl-+2H2O
C、用FeS除去工业废水中含有的Cu2+:S2-(aq)+Cu2+(aq) —→ CuS(s)↓
D、1L0.5mol·L-1稀硫酸与1L1mol·L-1氢氧化钠溶液反应放出57.3kJ的热量:
H2SO??4(aq)+2NaOH(aq)—→Na2SO4(aq)+2H2O(1)+57.3 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com