
分析 (1)根据实验操作的步骤(计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作)选择需要仪器;依据配制溶液体积选择合适规格容量瓶;
(2)根据n=cVm计算需要氢氧化钠质量;
(3)依据配制一定物质的量浓度溶液正确操作步骤解答;
(4)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)用固体配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、钥匙、量筒、烧杯、玻璃棒、容量瓶、胶头滴管,1.0mol/L的NaOH溶液220ml溶液,应选择250mL容量瓶,所以还需要的仪器:250mL容量瓶、胶头滴管;
故答案为:250mL容量瓶、胶头滴管;
(2)需要1.0mol/L的NaOH溶液220ml,应选择250mL容量瓶,实际配制250mL溶液,需要氢氧化钠的质量为:1.0mol/L×40g/mol×0.25L=10.0g;
故答案为:10.0;
(3)溶解后,移液前应待溶液冷却到室温再移液,移液后,用蒸馏水洗涤涤烧杯和玻璃棒2-3次,定容时,继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处,改用胶头滴管加水,使溶液凹液面恰好与刻度相切
;
故答案为:冷却;2-3;1-2cm;
(4)A.称量NaOH时,砝码错放在左盘(已移动游码),则实际称量固体质量为砝码质量减去游码质量,溶质的质量偏小,溶质的物质的量偏小,溶液浓度偏低,故A选;
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故B选;
C.加蒸馏水时不慎超过了刻度线,导致溶液体积偏大,溶液浓度偏低,故C选;
D.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故D不选;
E.配制前,容量瓶中有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故E不选;
故选:ABC.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,明确配制原理及操作步骤是解题关键,注意误差分析的方法.


科目:高中化学 来源: 题型:解答题
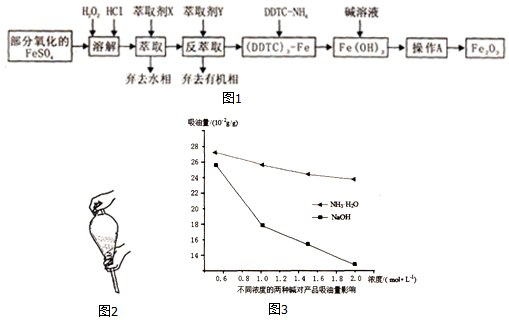
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
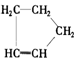 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 .环戊烯的化学性质跟烯烃相似.
.环戊烯的化学性质跟烯烃相似.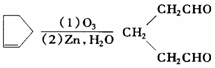
 )臭氧分解各种产物的结构简式及物质的量之比:HCHO、
)臭氧分解各种产物的结构简式及物质的量之比:HCHO、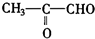 ;2:1.
;2:1.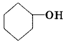 )合成乙二醛(
)合成乙二醛( 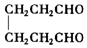 )的各步合成路线流程.
)的各步合成路线流程.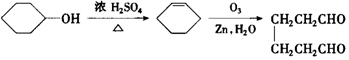 .
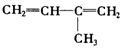
.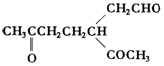 .A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.请写出A和B的结构简式(不必注明名称).
.A经催化加氢得产物B,B的分子式是C10H20.分析数据表明,分子B内含有六元碳环.请写出A和B的结构简式(不必注明名称).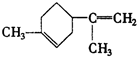 ,B是
,B是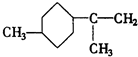 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和CO的混合气 | B. | C2H2O2 | C. | C3H6O3 | D. | C6H12O5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com