
| 5aV×10-3mol |
| 2×0.025mol |
| ||
|
| 50W |
| 9aV |
| 50W |
| 9aV |


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:
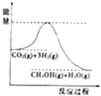 一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:
一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 固体样品的剩余质量 |
| 固体样品的起始质量 |
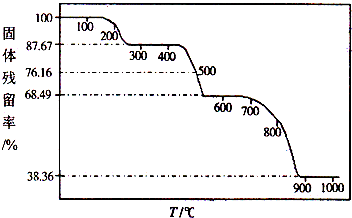
查看答案和解析>>
科目:高中化学 来源: 题型:
 为测定氨分子中氮、氢原子个数比,某研究性学习小组用浓氨水和氧化钙反应制取氨气,然后用氨气与氧化铜粉末发生氧化还原反应.设计了如下实验流程:实验中,先检查装置气密性;然后用制得的氨气排尽洗气瓶前所有装置中的空气;再连接洗气瓶和气体测量装置;立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
为测定氨分子中氮、氢原子个数比,某研究性学习小组用浓氨水和氧化钙反应制取氨气,然后用氨气与氧化铜粉末发生氧化还原反应.设计了如下实验流程:实验中,先检查装置气密性;然后用制得的氨气排尽洗气瓶前所有装置中的空气;再连接洗气瓶和气体测量装置;立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
查看答案和解析>>
科目:高中化学 来源: 题型:
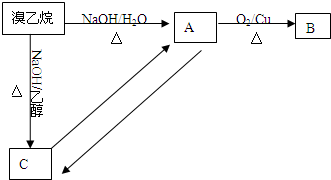
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 次序 | 稀盐酸(ml) | 剩余固体(g) |
| 1 | 先加入5.0 | 1.32 |
| 2 | 加入5.0 | 0.64 |
| 3 | 加入5.0 | 0.20 |
| 4 | 加入5.0 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com