
| A. | 同浓度的下列溶液:①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4,其中c(NH4+)由大到小的顺序是:①>②>③>④ | |
| B. | 相同温度下,将足量氯化银固体分别放入相同条件的①蒸馏水、②0.1mol•L-1盐酸、③0.1mol•L-1氯化镁溶液、④0.1mol•L-1硝酸银溶液中,Ag+浓度:①>④=②>③ | |
| C. | 常温下将NaHSO3和NaHCO3两溶液 混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(HSO3-)+c(HCO3-)+2c(CO32-)+2c(SO32-) | |
| D. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ |
分析 A、①铝离子水解抑制铵根离子的水解;②铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解;
B、溶液中含有氯离子或银离子都抑制氯化银溶解,且氯离子或银离子浓度越大其抑制程度越大;
C、依据溶液中电荷守恒分析判断;
D、酸或碱抑制水电离,含有弱离子的盐促进水电离,pH相等的不同酸,其抑制水电离程度相等.
解答 解:A、同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl③NH3•H2O,④CH3COONH4,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③弱碱电离,且电离的程度很弱;④醋酸根离子水解促进铵根离子水解,则c(NH4+)由大到小的顺序是:①>②>④>③,故A错误;
B、溶液中含有氯离子或银离子都抑制氯化银溶解,且氯离子或银离子浓度越大其抑制程度越大,银离子浓度最大的是④,溶液中氯离子浓度大小顺序是③>②>①,所以银离子浓度大小顺序是④>③>②>①,故C错误;
C、温下将NaHSO3和NaHCO3两溶液 混合后,则混合后的溶液中电荷守恒为:c(Na+)+c(H+)=c(HSO3-)+c(HCO3-)+2c(CO32-)+2c(SO32-)+c(OH-),溶液呈中性,c(H+)=c(OH-),得到c(Na+)=c(HSO3-)+c(HCO3-)+2c(CO32-)+2c(SO32-),故C正确;
D、酸或碱抑制水电离,含有弱离子的盐促进水电离,pH相等的不同酸,其抑制水电离程度相等,所以这三种物质 溶液中水电离出c(H+):①>②=③,故D错误;
故选C.
点评 本题考查离子浓度大小的比较,难度中等,熟悉酸的强弱与盐的水解的关系,电荷守恒、水解与电离的程度及相互影响是解答本题的关键.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 18g≤m≤128g | B. | 36g<m<180g | C. | 18g<m<128g | D. | 36g≤m≤180g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HAt>HCl | B. | 氧化性:At2>I2 | ||
| C. | At2为分子晶体 | D. | NaAt的水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同物质的量的NaCl和Cl2含有的分子数相等 | |
| B. | SO42-的摩尔质量是96g | |
| C. | 阿伏伽德罗常数约为6.02×1023mol-1 | |
| D. | 1摩尔氧气的质量等于NA个O2分子的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
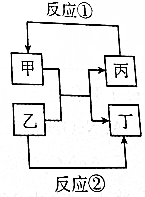 甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题:
甲、乙、丙、丁四种取值的相互转化关系如图所示(部分反应物、产物及反应条件已略去).已知甲为常见金属(Na、Mg、Al、Fe、Cu)或其氧化物,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | 胆矾 | C. | Fe(OH)3胶体 | D. | 液氯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com