
【题目】常温下pH=1的两种一元酸溶液A和B,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是 ( )
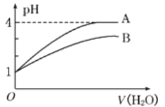
A.A酸比B酸的电离程度小
B.B酸比A酸容易电离
C.A是弱酸,B是强酸
D.pH=1时,B酸的物质的量浓度比A酸大
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】化学是一门实用性很强的科学,与社会、环境等密切相关。下列说法错误的是
A.用![]() 合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
B.用含橙色酸性重铬酸钾的仪器检验酒驾,利用了乙醇的挥发性和还原性
C.浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果
D.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如图所示:下列说法正确的是( )

A.pH=7.2时,溶液中c(H2PO4ˉ)+c(HPO42-)+c(OHˉ)=c(Na+)+c(H+)
B.曲线1和曲线2分别表示δ(H3PO4)和δ(HPO42-)的变化
C.pH=12.3时,溶液中由水电离出的c(H+)=10-12.3mol/L
D.25℃时,H3PO4的电离常数K1=10-2.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) △H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) △H。已知该反应中相关化学键的键能数据如下:

则该反应的△H=___________kJ·mol-1
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为:CO(g)+2H2(g) CH3 OH(g) △H<O
在一定条件下,将1 mol CO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH2OH的体积分数![]() (CH3OH)变化趋势如图所示:
(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___________。
②某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________。
(3)合成甲醇所需的氢气,工业上常从一种合成气(主要成分为CO2、H2)中分离。H2提纯过程示意图如下:

①吸收池中发生反应的离子方程式是___________。
②用电极反应式和离子方程式表示K2CO3溶液的再生原理___________。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g) 2HI(g)的△H=___________0(填“大于”或“小于”)。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-I3-,图2中曲线b代表的微粒是___________(填微粒符号),由图2可知,要提高碘的还原率,除控制温度外,还可以采取的措施是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的烃分子。
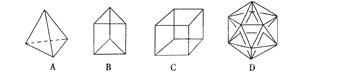
(1)结构D显然是不可能合成的,原因是_____。
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷的结构,写出金刚烷的分子式____。
(3)B的一种同分异构体是最简单的芳香烃(含苯环),能证明该芳香烃中的化学键不是单双键交替排列的事实是____。
a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等 d.能发生取代反应和加成反应
(4)C的一种属于芳香烃(含苯环)的同分异构体是生产某塑料的单体,写出合成该塑料的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T0℃时,在2 L的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
图a 图b
图b
A.该反应的正反应是吸热反应
B.T1℃时,若该反应的平衡常数K =50,则T1<T0
C.图a中反应达到平衡时,Y的转化率为37.5%
D.T0℃,从反应开始到平衡时:v(X)=0.083 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿![]() 主要成分
主要成分![]() ,质量分数为
,质量分数为![]() 冶炼铜的主要流程如图:
冶炼铜的主要流程如图:
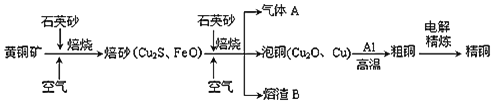
己知:一定条件下,铝可以和某些金属氧化物反应置换金属。
(1)高温焙烧前要将黄铜矿粉碎的目的是______。
(2)气体A中的大气污染物可选用下列试剂中的______吸收。
![]() 浓
浓![]()
![]() 稀
稀![]()
![]() 溶液
溶液![]() 氨水
氨水
(3)用稀![]() 浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在______,欲检验溶液中还存在
浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在______,欲检验溶液中还存在![]() ,所需试剂是______。
,所需试剂是______。
(4)由泡铜冶炼粗铜的化学反应方程式为______。
(5)某同学用铜、稀硫酸和![]() 制备
制备![]() 溶液,其化学反应方程式为______。
溶液,其化学反应方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香油酚经多步反应合成(见图)。有关上述两种化合物的说法不正确的是( )
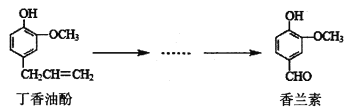
A.在丁香油酚分子中至少有12个原子共平面
B.常温下,1mol丁香油酚可与2molBr2反应
C.1moI香兰素最多能与4mol氢气发生加成反应
D.可用酸性KMnO4溶液检验丁香油酚中是否含有碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com