
下列说法不正确的是()
A. 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B. 一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积
C. 某气态烃CxHy与足量O2恰好完全反应(温度>100℃),如果反应前后气体体积不变,则y=4
D. 相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高
考点: 有关有机物分子式确定的计算.
专题: 烃及其衍生物的燃烧规律.
分析: A、根据质量守恒定律;
B、根据浓硫酸吸收的是水蒸气,烃燃烧前后气体的体积也可能发生变化;
C、根据方程式CxHy+(x+ )O2
)O2 xCO2+
xCO2+ H2O(g)来判断;
H2O(g)来判断;
D、等质量的烃完全燃烧时,烃分子中的含H量越大,耗氧量越大.
解答: 解:A、生成物中含有碳、氢元素,依据质量守恒定律可知该物质中一定含有碳、氢元素,氧元素不能确定,无法确定有机物的组成,故A错误;
B、浓硫酸吸收的是水蒸气,烃燃烧前后气体的体积也可能发生变化,所以烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积不一定时生成的水蒸气的体积,故B错误;
C、温度>100℃,生成的水为气态,根据CxHy+(x+ )O2
)O2 xCO2+
xCO2+ H2O(g),如果反应前后气体体积不变则有:1+(x+
H2O(g),如果反应前后气体体积不变则有:1+(x+ )=x+
)=x+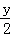 ,解得y=4,故C正确;
,解得y=4,故C正确;
D、由C~O2~CO2,4H~O2~2H2O进行比较,消耗1molO2,需要12gC,而消耗1molO2,需要4gH,可知有机物含氢量越大,等质量时消耗的O2越多,故D正确;
故选:AB.
点评: 本题考查有机物燃烧,涉及耗氧量、有机物组成、体积变化等,难度不大,注意根据燃烧通式进行理解,注意规律的掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
按要求作答
(1)写出钠和水应的离子方式 ;
(2)写出氯化铝和氨水反应的化学方式 ;
(3)除去混入NaCl溶液中少量NaHCO3杂质的试剂是 ,离子方程式为 .
(4)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机物分子中,可形成顺反异构的是()
A. CH2=CHCH3 B. CH2=CHCH2CH3 C. CH3CH=C(CH3)2 D. CH3CH=CHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6gH2O,下列说法正确的是()
A. 混合气体中一定有甲烷 B. 混合气体一定是甲烷和乙烯
C. 混合气体中一定没有乙炔 D. 混合气体中一定有丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧化锂(LiAlH4)既是金属储氢材料又是有机合成中常用的试剂,溶于适量的水可得到无色溶液:LiAlH4+2H2O═LiAlO2+4H2↑,在125℃分解为LiH、H2和Al.下列说法不正确的是()
A. LiAlH4中H元素的化合价为﹣1
B. LiAlH4L、iAlO2、LiH均是离子化合物
C. 1mol LiAlH4在125℃完全分解,转移4mol电子
D. 0.5 mol LiAlH4与水充分反应后产生44.8L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
C、O、Si、Cl、Na、Fe是中学化学中常见的六种元素.
(1)Si位于元素周期表第三周期第ⅣA族,Fe2+的离子结构示意图 ,Cl的基态原子外围电子层排布式为 ;
(2)用“>”或“<”填空:
第一电离能 键能 沸点
O Na H﹣Cl H﹣Si CO2 H2O
(3)氯的一种常见含氧酸有漂白性,它与H2CO3酸性强弱不同,写出可以证明此结论一个化学方程式 ;
(4)黄绿色气体二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.工业上常利用氯酸钠和浓盐酸来制备ClO2,同时还得到一种黄绿色的气体单质、一种无色液体和一种常见离子化合物.写出该反应的化学方程式,并标出电子转移的方向和数目: ;
(5)Ti倍称为继铁铝之后“21世纪”金属,应用前景很广.钛铁矿(FeTiO3)可被一氯化碳还原为铁和TiO2固体.在25℃、101KPa下,已知煤消耗7克CO,吸收aKJ热量,该反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,在容积为2L的密闭容器中,将2mol 气体M和3mol N气体混合,发生如下反应:2M(g)+3N(g)⇌x Q(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4mol/L,下列有关叙述正确的是()
A. x值为2 B. 混合气体的密度增大
C. 平衡时N的浓度为0.3 mol/L D. N的转化率为20%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com