
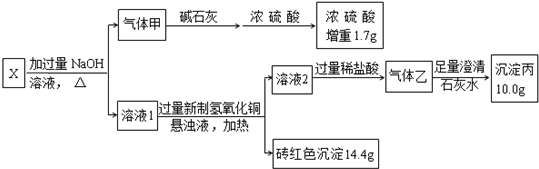
 ,写出气体甲的电子式
,写出气体甲的电子式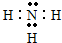 .
.分析 X与过量的NaOH溶液加热反应生成的气体甲为氨气,用碱石灰干燥氨气后,浓硫酸增重的1.7g为氨气,物质的量为:$\frac{1.7g}{17g/mol}$=0.1mol;得到的溶液1与新制的氢氧化铜悬浊液反应生成砖红色沉淀,该沉淀为Cu2O,溶液1为钠盐,则溶液1中溶质为甲酸钠;溶液2与足量稀盐酸反应生成的气体为二氧化碳,二氧化碳与澄清石灰水反应生成碳酸钙沉淀,10g碳酸钙的物质的量为:$\frac{10g}{100g/mol}$=0.1mol;溶液2的溶质为碳酸钠,则X为HCOONH4,
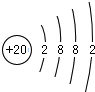
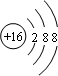
(1)沉淀丙为碳酸钙,其含有的金属元素为Ca,钙原子的原子序数为20,核外电子总数为20、最外层含有2个电子,据此画出其原子结构示意图;气体甲为氨气,氨气为共价化合物,分子中含有3个氮氢键,据此写出其电子式;
(2)根据分析可知,X为甲酸铵;
(3)甲酸钠中含有醛基,能够与新制的氢氧化铜浊液反应生成氧化亚铜沉淀;
(4)氧化亚铜与氢气在加热条件下反应生成铜和水,据此写出反应的方程式;根据反应Cu2O+2H+=Cu+Cu2++H2O设计检验方案.
解答 解:X与过量的NaOH溶液加热反应生成的气体甲为氨气,用碱石灰干燥氨气后,浓硫酸增重的1.7g为氨气,物质的量为:$\frac{1.7g}{17g/mol}$=0.1mol;得到的溶液1与新制的氢氧化铜悬浊液反应生成砖红色沉淀,该沉淀为Cu2O,溶液1为钠盐,则溶液1中溶质为甲酸钠;溶液2与足量稀盐酸反应生成的气体为二氧化碳,二氧化碳与澄清石灰水反应生成碳酸钙沉淀,10g碳酸钙的物质的量为:$\frac{10g}{100g/mol}$=0.1mol;溶液2的溶质为碳酸钠,则X为HCOONH4,
(1)沉淀丙为碳酸钙,碳酸钙中含有的金属元素为Ca,钙原子的核电荷数=核外电子总数=20,其原子结构示意图为: ;气体甲为氨气,氨气为共价化合物,分子中含有3个氮氢键,其电子式为:
;气体甲为氨气,氨气为共价化合物,分子中含有3个氮氢键,其电子式为: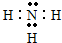 ,
,
故答案为: ;
;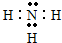 ;
;
(2)根据分析可知,X的化学式为:HCOONH4,
故答案为:HCOONH4;
(3)得到的溶液1与新制的氢氧化铜悬浊液反应生成砖红色沉淀,该沉淀为Cu2O,该反应为甲酸钠与氢氧化铜、氢氧化钠反应生成碳酸钠、氧化亚铜沉淀和水,反应的化学方程式为:HCOONa+2Cu(OH)2+NaOH$\stackrel{△}{→}$Na2CO3+Cu2O↓+3H2O,
故答案为:HCOONa+2Cu(OH)2+NaOH$\stackrel{△}{→}$Na2CO3+Cu2O↓+3H2O;
(4)氧化亚铜与氢气在加热条件下反应生成铜和水,反应方程式为:Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
氧化亚铜能够与酸反应:Cu2O+2H+=Cu+Cu2++H2O,反应后生成的溶液为蓝色,据此可以检验产物中是否含有氧化亚铜,具体操作方法为:取少量反应产物于试管中,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O,
故答案为:Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;取少量反应产物于试管中,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O.
点评 本题考查了探究物质组成的方法,题目难度中等,明确甲酸盐具有醛的性质为解答关键,注意掌握常见物质的组成、性质及检验方法,(4)中性质实验方案的设计为易错点,注意成分利用题中已知信息及铜离子的颜色进行分析.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①③ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6gCH4中含有的电子数 | |
| B. | 100mL1mol/LH2SO4中含有H+的数 | |
| C. | 24gMg与足量稀盐酸反应转移的电子数 | |
| D. | 标准状况下,22.4LCO气体中含有的原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| T | Z | W |
| A. | X、Y两种元素最低价氢化物的稳定性后者大 | |
| B. | Z、W 元素最高价氧化物对应的水化物酸性后者强 | |
| C. | X与Z形成的晶体类型为分子晶体 | |
| D. | T分别与X、Y、W 形成的化合物均具有熔点高,硬度大的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
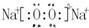 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.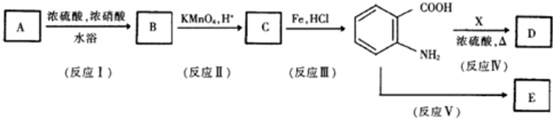
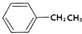 .
.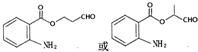 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)=$\frac{1}{2}$O2(g)=H2O(I)△H>-241.8kJ•mol-1 | |
| B. | H2的燃烧热△H=-241.8 kJ.mol-1 | |
| C. | H2(g)转变成H2O(g)的化学反应一定放出能量 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2(g)的△H=-41.2kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,F元素周期表的位置:第三周期第ⅦA族,C2B2的电子式为:
,F元素周期表的位置:第三周期第ⅦA族,C2B2的电子式为: .AB2的结构式为:O=C=O.该化合物是由极性(填“极性”、“非极性”)键形成的.
.AB2的结构式为:O=C=O.该化合物是由极性(填“极性”、“非极性”)键形成的.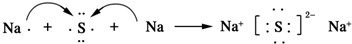 .该化合物属于离子(填“共价”或“离子”)化合物.
.该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 63.47 | B. | 64.47 | C. | 63.57 | D. | 64.57 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com