
【题目】
(1)在图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是______.
(2)在容量瓶的使用方法中,下列操作不正确的是______
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
E.盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取NaOH固体的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.
【答案】(1)A、C (少一个扣一分,下同);烧杯、玻璃棒、500mL容量瓶
(2)B、C、D ;(3)2.0g;小于 ;(4)13.6;15
【解析】试题:(1)配制一定物质的量浓度的溶液所必需的仪器有:一定规格的容量瓶,托盘天平、烧杯、玻璃棒、胶头滴管,量筒可用可不用,
故答案为:A、C;烧杯、玻璃棒、500mL容量瓶;
(2)根据容量瓶使用时的注意事项:使用容量瓶前检验是否漏水、容量瓶用水洗净后,不能用待配溶液洗涤、不能盛放热溶液、不能作为稀释仪器等,
故答案为:B、C、D;
(3)容量瓶没有450ml,应选择500ml的来配置,据公式m=nM=cvM=0.1mol/L×0.5L×40g/mol=2.0g,若定容时仰视刻度线,则实际溶液体积超过500mL,故所得浓度偏小,
故答案为:2.0g;小于;
(4)设浓硫酸的体积为VmL,稀释前后溶质的质量不变,则:98%×1.84g/cm3V=0.5mol/L×0.50L×98g/mol,解得V=13.6mL,
为减小误差,应选用15mL的量筒,


科目:高中化学 来源: 题型:
【题目】已知下列两个反应:
① 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
②3Cu2S + 22HNO3 = 6Cu(NO3)2 + 3H2SO4 + 10NO↑ + 8H2O
试回答下列问题:
(1)反应①中___________(填化学式)作氧化剂;Cu发生__________(填“氧化”或“还原”)反应;用双线桥表示出反应①的电子转移方向和数目______。
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
(2)将反应②改写为离子方程式__________________________(提示:Cu2S不溶于水)
(3)反应②中Cu2S中Cu的化合价为______;___________(填元素符号)元素被氧化,还原产物为_____________。
(4)当反应②中生成2.24L(标准状况下)NO气体,消耗HNO3的质量为__________g,其中有_________mol HNO3被还原,共转移电子_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了制备氯气,某同学查阅资料发现实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)请用双线桥法对该反应进行标注________________。
(2)写出该反应的离子方程式________________。
(3)该反应中,氧化剂和还原剂之比是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L的盐酸滴定0.1mol/L的Na2CO3溶液25mL。测得溶液pH变化曲线如图,下列说法正确的是( )
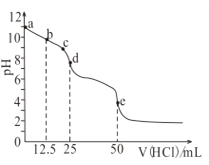
A. b点时,c(CO32-)>c(HCO3-)>c(OH-)
B. d点时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C. e点时,c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. c→d发生的主要离子反应:H++HCO3-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯的说法错误的是( )
A.苯可以燃烧
B.苯分子的结构是平面正六边形
C.苯具有较强挥发性,有毒
D.苯的结构中含有碳碳双键,可以使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组将无水FeCl3与氯苯混合发生反应制备常用还原剂FeCl2,反应原理是:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑。按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3和225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。将生成的HCl用水吸收,利用莫尔法可以测出无水FeCl3的转化率(莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法)。
2FeCl2+C6H4Cl2+HCl↑。按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3和225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。将生成的HCl用水吸收,利用莫尔法可以测出无水FeCl3的转化率(莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法)。

已知有关数据如下:
C6H5Cl | C6H4Cl2 | |
熔点/℃ | -45 | 53 |
沸点/℃ | 132 | 173 |
回答下列问题:
(1)仪器b的作用是_______。干燥管c中盛装的试剂是________。
(2)反应结束后需向反应器a中吹入干燥的氮气,其目的是_________。
(3)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是_____(填序号)。

(4)从滤液中回收过量氯苯的操作是___________。
(5)将锥形瓶内溶液的pH调至6.0再加水稀释至1000mL,从中取10.0mL滴加几滴指示剂,用 0.2000mol/LAgNO3溶液进行滴定,当达到终点时,消耗22.50mLAgNO3溶液。
AgCl | AgBr | AgI | Ag2CrO4 | |
Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
颜色 | 白 | 淡黄 | 黄 | 砖红 |
①参照上表已知信息用硝酸银标准溶液滴定氯离子含量时可以作指示剂的是___(填字母)。
a.CaCl2 b.NaBr c.NaI d.K2CrO4
②滴定达终点的现象是_______
③无水FeC13的转化率a=_______%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中错误的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.原电池放电时,电流的方向是从正极到负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A. 1 mol Cl2作为氧化剂得到的电子数为NA
B. 在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C. 25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
D. 将0.1 mol FeCl3加到沸水中制得的胶体中,含胶粒0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com