
【题目】肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。已知200℃时:反应 I : 3N2H4(g)=N2(g)+4NH3(g) Hl=-32.9kJ·mol-1 , 反应II: N2H4(g)+H2(g)=2NH3(g)H2=-41.8 kJ·mol-1,下列说法不正确的是

A. 图l所示过程①、②都是放热反应
B. 反应Ⅱ的能量过程示意图如图2所示
C. 断开3 molN2H4(g)中的化学键吸收的能量小于形成1 molN2(g)和4 molNH3(g)中的化学键释放的能量
D. 200℃时,肼分解生成氨气和氢气的热化学方程式为:N2H4(g) =N2(g)+2H2 (g) H=+50.7kJ·mol-1
【答案】A
【解析】
A. 上图所示过程①为反应I为放热反应,过程②为氨气分解生成氮气和氢气,为III×3-I即可判断反应为吸热反应;
B. 反应Ⅱ为放热反应,反应物的总能量大于生成物的总能量,能量过程示意图正确;
C. 反应I为放热反应,则断开3 molN2H4(g)中的化学键吸收的能量小于形成1 molN2(g)和4 molNH3(g)中的化学键释放的能量;
D. 200℃时,肼分解生成氨气和氢气的反应为I-II×2可得到N2H4(g) =N2(g)+2H2 (g) H=+50.7kJ·mol-1;
A. 上图所示过程①为反应I为放热反应,过程②为氨气分解生成氮气和氢气,为III×3-I即可判断反应为吸热反应,A错误;
B. 反应Ⅱ为放热反应,反应物的总能量大于生成物的总能量,能量过程示意图正确,B正确;
C. 反应I为放热反应,则断开3 molN2H4(g)中的化学键吸收的能量小于形成1 molN2(g)和4 molNH3(g)中的化学键释放的能量,C正确;
D. 200℃时,肼分解生成氨气和氢气的反应为I-II×2可得到N2H4(g) =N2(g)+2H2 (g) H=+50.7kJ·mol-1,D正确;
答案为A


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:

(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示:
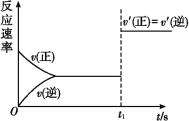
则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度 B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积 D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从废定影液[含Ag(S2O3)23-和Br-等]中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取C12并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如下图所示:
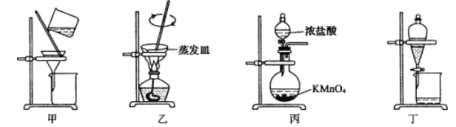
下列叙述正确的是
A. 用装置甲分离Ag2S时,用玻璃棒不断搅拌
B. 用装置乙在通风橱中高温灼烧Ag2S制取Ag
C. 用装置丙制备用于氧化过滤液中Br-的Cl2
D. 用装置丁分液时,先放出水层再换个烧杯继续放出有机层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13,则在该温度下,将100 mL 0.10 mol/L的稀硫酸与100 mL 0.40 mol/L的NaOH溶液混合后,溶液的pH为(已知:忽略混合时体积的变化;lg2=0.30;lg3=0.48)
A. 11.52 B. 11.70
C. 11.82 D. 12.00
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. NaHCO3溶液与盐酸反应:CO32-+2H+=CO2↑+H2O
B. 足量酸性KMnO4溶液与双氧水反应:2MnO4-+7H2O2+6H+=2Mn2++6O2↑+10H2O
C. NaHSO4溶液中滴加Ba(OH)2溶液至中性:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O
D. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++ OH- ![]() NH3 ↑+ H20
NH3 ↑+ H20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,H2R的钠盐溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(ɑ)随溶液pH变化关系如图所示,下列叙述不正确的是
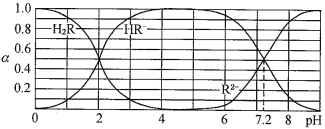
A. H2R属于二元弱酸
B. pH=8时,溶液中c(Na+)>c(R2-)>c(HR-)>c(OH-)>c(H+)
C. 若c(H2R)+2c(R2-)+c(OH-)=c(H+),则pH一定小于2
D. 配制c(R2-)=c(HR-)的钠盐溶液应控制溶液的pH=7.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,它们使用的药品和装置如图所示:
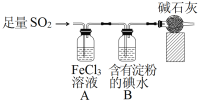
(1)装置A中的实验现象是____,B中反应的离子方程式是____。
(2)为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入NaOH溶液,产生白色沉淀,并迅速转为灰绿色,最后呈红褐色。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案中不合理的方案是______,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.阿司匹林是一种解热镇痛药,又称乙酰水杨酸,是家庭常备药。将阿司匹林与聚甲基丙烯酸羟乙酯嫁接起来得到长效缓释阿司匹林,其不仅有阿司匹林的功效,也可作抗血栓长效药使用。两种物质的结构简式如下所示:
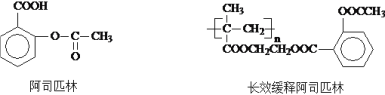
(1)阿司匹林通常在餐后服用,是因为它含有_______(填写官能团符号),易刺激肠胃,给胃部带来不适。
(2)分析说明长效缓释阿司匹林在人体内产生阿司匹林的过程以及长效缓释药品的优点______________
II.以丙酮为主要原料合成长效缓释阿司匹林的流程如下图所示:
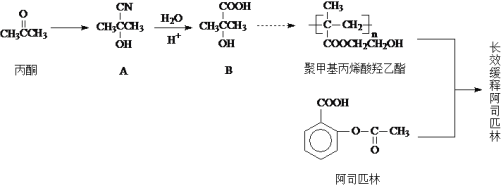
(3)由丙酮得到A的反应类型是_________,还需要的反应物是__________(填化学式)。
(4)写出一种满足下列条件的阿司匹林的同分异构体的结构简式____________。
①能发生银镜反应
②能与NaHCO3溶液反应生成CO2气体 ③能在铜作催化剂的条件下发生催化氧化反应
(5)由B和乙二醇(HOCH2CH2OH)为原料可以制得聚甲基丙烯酸羟乙酯,写出其合成路线(无机试剂任选)___________________。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为铜锌原电池示意图,下列说法正确的是
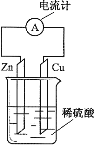
A. 锌片逐渐溶解 B. 烧杯中溶液逐渐呈蓝色
C. 电子由铜片通过导线流向锌片 D. 该装置能将电能转变为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com