
| A. | 温度越高,K值越大 | B. | K值越大,正反应速率越大 | ||
| C. | K值的大小与起始浓度有关 | D. | K值越大,反应物的转化率越大 |
分析 平衡常数K等于生成物平衡浓度幂次方乘积与反应物平衡浓度幂次方乘积的比值,K越大,说明正反应进行程度越大,反应物的转化率越大,平衡常数只与温度有关,不随其他外界条件的影响,据此分析解答.
解答 解:A.如果正反应是吸热反应,温度越高,平衡越向正反应方向移动,则K值越大,如果正反应是放热反应,温度越高,平衡越向逆反应方向移动,则K值越小,故A错误;
B.K值越大,反应物转化的量越多,则反应的转化率越大,K只表达了反应的进行程度大小,和反应快慢无关,K越大反应速率不一定越大,故B错误;
C.K值大小只与温度有关,与反应的初始浓度无关,故C错误;
D.K值越大,说明正反应进行程度越大,反应物转化的量越多,则反应的转化率越大,故D正确;
故选D.
点评 明确化学平衡K的含义是解本题关键,知道K值大小的影响因素,知道所有的平衡常数只与温度有关,与物质的浓度无关,化学平衡常数表达式中不含固体和纯液体,题目难度较小.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
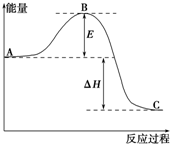 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NaA溶液pH=10 | B. | 0.01 mol•L-1 HA溶液的pH=4 | ||
| C. | pH=2的HA溶液稀释100倍后pH=3.5 | D. | HA溶液跟锌反应,放出H2很慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
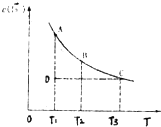 已知,I2(aq)+I-(aq)?I3-(aq).某I2、KI溶液中,c(I3-)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
已知,I2(aq)+I-(aq)?I3-(aq).某I2、KI溶液中,c(I3-)与温度(T)的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A. | 反应I2(aq)+I-(aq)?I3-(aq)△H>0 | |
| B. | 状态A的c (I2)比状态D的小 | |
| C. | A点对应的反应速率大于C点对应的反应速率 | |
| D. | 其他条件不变,向溶液中加入KI固体,平衡由C点移动到D点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| B. | 1.0 mol/L NH4Cl溶液:c(NH4+)=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 1 mol/L CH3COONa溶液,c(CH3COO-)=1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 标准状况下,22.4L水中含有NA个水分子 | |
| C. | 标准状况下,22.4L氯化氢所含的原子数为NA | |
| D. | 化学反应中1mol金属镁变成镁离子时失去电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力.
保持营养平衡、科学使用食品添加剂并合理使用药物,有助于健康和提高人体自身免疫力.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com