
分析 NaCl晶体是离子晶体,不存在分子,但温度达到1413℃时,NaCl晶体形成气体,并以分子形式存在,相当于分子晶体,n(NaCl)=$\frac{5.6L}{22.4L/mol}$=0.25mol,M=$\frac{m}{n}$=$\frac{29.25g}{0.25mol}$=117g/mol,摩尔质量在数值上等于其相对分子质量,所以该条件下氯化钠的相对分子质量是117,据此判断化学式.
解答 解:NaCl晶体是离子晶体,不存在分子,但温度达到1413℃时,NaCl晶体形成气体,并以分子形式存在,相当于分子晶体,n(NaCl)=$\frac{5.6L}{22.4L/mol}$=0.25mol,M=$\frac{m}{n}$=$\frac{29.25g}{0.25mol}$=117g/mol,摩尔质量在数值上等于其相对分子质量,所以该条件下氯化钠的相对分子质量是117,则该分子中含有2个NaCl,化学式为Na2Cl2,故答案为:Na2Cl2.
点评 本题考查晶胞计算,为高频考点,侧重考查学生分析判断及获取信息运用信息能力,明确“温度达到1413℃时,NaCl晶体形成气体,并以分子形式存在”是解本题关键,很多学生往往认为氯化钠是离子晶体不存在分子而导致错误,为易错题.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
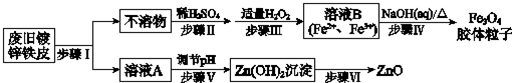
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:Ca(OH)2>Mg(OH)2 | B. | 酸性:H3BO3>H2CO3 | ||
| C. | 热稳定性:NH3<PH3 | D. | 还原性:S2-<F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁带中混有与酸不反应的杂质 | |
| B. | 装置接口连接处有气体泄漏 | |
| C. | 液体量瓶刻度读数未扣去硫酸的体积 | |
| D. | 硫酸注入量不足,镁带未反应完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
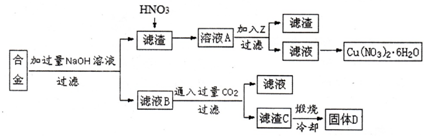
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、SO42-、Cl- | B. | K+、OH-、HCO3- | C. | Mg2+、SO42-、Cl- | D. | Cu2+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O(g)═2H2(g)+O2(g)△H=-483.6 kJ•mol-1(△H代表反应热) | |
| B. | C(s)+O2(g)═CO2(g)△H=+393.5kJ/mol((△H代表反应热) | |
| C. | 2HNO3(aq)+Ba(OH)2(aq)═Ba(NO3)2(aq)+2H2O(l);△H=+114.6KJ/mol(△H代表反应热) | |
| D. | HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol((△H代表中和热) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com