
| A、化学物质发生反应放热或吸热由反应物和生成物的总能量决定 | B、可通过将煤粉碎等措施提高煤燃烧效率 | C、核能利用有可能造成辐射危害,故应限制其发展 | D、煤的气化和液化是高效、清洁地利用煤炭的重要途径 |


科目:高中化学 来源: 题型:
 碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 序号 | 分解水的过程 | 平衡常数 | T=2500K | T=3000K |
| A | H2O(g)?HO(g)+H(g) | K1 | 1.34×10-4 | 8.56×10-3 |
| B | HO(g)?H(g)+O(g) | K2 | 4.22×10-4 | 1.57×10-2 |
| C | 2H(g)?H2(g) | K3 | 1.52×103 | 3.79×10 |
| D | 2O(g)?O2(g) | K4 | 4.72×103 | 7.68×10 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
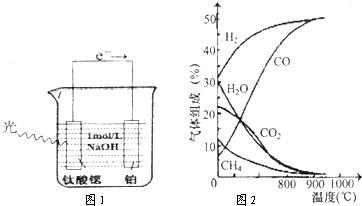
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
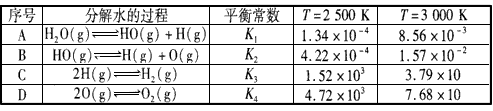
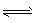 H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。
H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。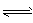 H2 (g) +1/2O2 ( g) △H=-___kJ/mol。
H2 (g) +1/2O2 ( g) △H=-___kJ/mol。 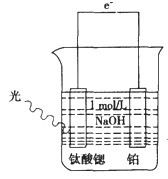
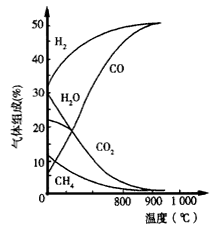
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com