
【题目】下列各物质转化关系如图所示,气体B为红棕色,C常温时为无色液体,相对分子质量D比B大17,E的原子序数为12。
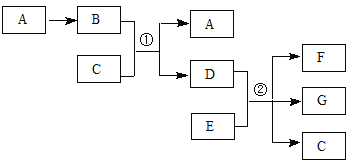
回答下列问题:
(1)A的化学式是 ,C分子的电子式是 。
(2)反应①的离子方程式是 ;若n(E)∶n(D)=2∶5,反应②的化学方程式是 。
【答案】(1)NO ;![]()
(2)3NO2+H2O=2H++2NO3-+NO
4Mg+10HNO3=4 Mg(NO3)2+N2O↑+ 5H2O或4Mg+10HNO3=4 Mg(NO3)2+NH4NO3+3H2O
【解析】
试题分析:A能生成B,气体B为红棕色,C常温时为无色液体,B与C反应生成A与D,相对分子质量D比B大17,则A为NO,B为NO2,C为H2O,D为HNO3,E的原子序数为12,则E为Mg。
(1)根据上述推断,A为一氧化氮,化学式为NO;C为水,水是共价化合物,电子式为![]() 。
。
(2)反应①是二氧化氮与水反应生成硝酸和NO,反应的离子方程式为3NO2 +H2O=2H++2NO3-+ NO;若n(E)∶n(D)=2∶5,设镁的物质的量为2mol,则硝酸的物质的量为5mol,2molMg失去4mol电子,生成2mol硝酸镁[Mg(NO3)2],起酸性作用的硝酸为4mol,根据氮原子守恒,得电子的硝酸是1mol,根据得失电子守恒,1molHNO3得4mol电子生成+1价氮的化合物,所以反应②的化学方程式是4Mg+10HNO3=4 Mg(NO3)2+N2O↑+ 5H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。右图为RFC工作原理示意图,下列有关说法正确的是
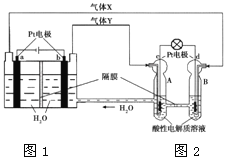
A. 图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用
B. 当有0.1 mol电子转移时,a极产生0.56 L O2(标准状况下)
C. c极上发生的电极反应是:O2+ 4H++ 4e-= 2H2O
D. 图2中电子从c极流向d极,提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究。
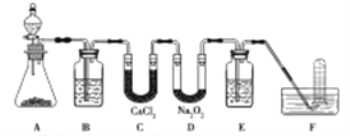
(1)A是实验室制取CO2的装置,其中发生反应的离子方程式是________;装置B的作用是____________。
(2)检验F中气体成分,即能说明过氧化钠可作潜水艇供氧剂,则实验操作的方法及现象是_______________。
(3)查阅有关资料表明:2H2O+2Na2O2=4NaOH+O2↑。某研究小组用同位素标记法对过氧化钠进行标记(![]() ),以探究这一反应的历程:_________________
),以探究这一反应的历程:_________________
①甲同学从电子转移角度得出其离子方程式为:_______________。
②乙同学发现:向Na2O2与水反应后的溶液中加入MnO2,又产生无色能使带火星的木条复燃的气体,从这个角度,写出其反应历程:___________________。
(4)设计并完成过氧化钠样品(已知所含杂质与酸碱均不反应)的纯度测定:
甲、乙两位同学各取了ag样品并分别配制成了100.00mL溶液进行实验,实验操作中甲同学是将样品直接溶于蒸馏水中;而乙同学却是将蒸馏水先加热煮沸,再把蒸馏水分成两份,一份中趁热加入样品溶解,待冷却到室温后再加人另一份水来进行配制。他们分别取出各自配制的溶液20.00mL,加入酚酞数滴后,用浓度为cmol/L的盐酸进行滴定;重复滴定操作2次,甲同学和乙同学分别计算出了所用盐酸的体积平均值,分别为VAmL和VWmL。
①在样品的溶解与配制中,你认为_______(填“甲”、“乙”)同学的操作是合理的,理由是:__________________。
②另一同学的操作将会使实验结果______(填“偏大”、“偏小”或“无影响”)。
③原过氧化钠样品的纯度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
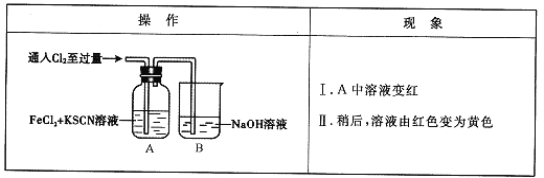
(1)B中反应的离子方程式是_ ___。
(2)A中溶液变红的原因是__ __。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应。
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN-的电子式为![]()
①甲同学认为SCN-中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是 。
③通过实验证明了SCN-中氮元素转化为NO3-。
④若SCN-与Cl2反应生成1 mol CO2,则转移电子的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一。其工艺流程如下:
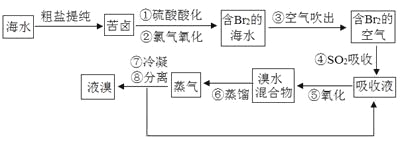
(1)步骤①中氯气氧化溴离子时在pH=3.5的酸性条件下效果最好,当使用精确pH试纸(能读数到0.1)检测步骤②氯气氧化的溶液的pH时,发现其颜色变化失常,则pH检测失败的原因是 。
(2)步骤④中反应的化学方程式为 ,该反应中体现了SO2的 性(填“氧化”或“还原”)。
(3)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,在实验室可用分液漏斗进行分离。分离时从分液漏斗的上口倒出的是 。
(4)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的 过程,与直接蒸馏含Br2的海水相比优点是消耗更少成本降低和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式_____________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是____________。
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为__________,制得的气体可用如图所示装置收集,则气体应从______(填“A”或“B”)通入。
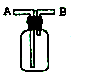
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,若向X的浓溶液中滴加浓NaOH 溶液至过量,现象依次为_______、_________、__________。
(5)取一定量的X晶体分解,若生成F 1mol,则必同时生成____物质______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com