
| A、醋酸溶液和氢氧化钠溶液的反应:H++OH-═H2O | ||||
| B、硫酸铜溶液与氢氧化钡溶液的反应:Ba2++SO42-═BaSO4↓ | ||||
| C、向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ | ||||
D、用氢氧化钠溶液检验氯化铵溶液中铵根离子:NH4++OH-
|
| ||


科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Z>Y>X |
| B、X与R的核电荷数相差18 |
| C、气态氢化物稳定性:W>R |
| D、Y与Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | ||
| B、加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3- | ||
| C、c(Fe3+)=0.1 mol?L-1的溶液:H+、Al3+、Cl-、SCN- | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于25.3% |
| B、小于25.3% |
| C、等于25.3% |
| D、约等于25.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3和Na2CO3混合溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B、常温下,浓度均为0.1mol?L-1下列各溶液的pH:NaOH>Na2CO3>NaHCO3>NH4Cl |
| C、向冰醋酸中逐滴加水,醋酸的电离程度、pH均先增大后减小 |
| D、常温下,pH=1的稀硫酸与醋酸溶液中,c(SO42-)与c(CH3COO-)之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 资料 |  聚乙烯可做 包装材料 |
 分类收集垃圾有利于资源的回收利用 |
 水果、蔬菜、肉类都含重要的营养物质 |
 服用补铁剂同时服用Vc片 |
| 说法 | 无毒,用于食品、药品包装 | 废旧手机电池放入此标志的垃圾桶 | 柠檬是酸性食品,肉类是碱性食品 | 利用Vc酸性OTC表示非处方药 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
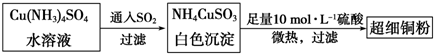
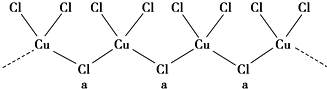
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com