
A.混合液的pH=7
B.a = b
C.混合液中KW=[c(H+)]2
D.a = b,VA=VB
科目:高中化学 来源: 题型:

 2C
2C 2C
2C| c2(C) |
| c(A)?c2(B) |
| c2(C) |
| c(A)?c2(B) |
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)
法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
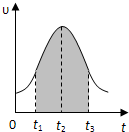 I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.回答如下问题:
I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.回答如下问题:
| V | 3 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
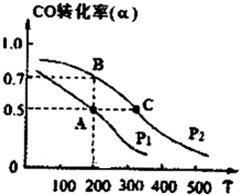 (2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.
(2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com