
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
科目:高中化学 来源: 题型:选择题
| A. | 乙烯聚合为聚乙烯高分子材料符合绿色化学原子经济性要求 | |
| B. | 纤维素、葡萄糖和脂肪在一定条件下都发生水解反应 | |
| C. | 石油分馏可获得乙烯、乙酸、苯及其衍生物等 | |
| D. | 一氯甲苯只有1种空间构型,说明甲烷是空间正四面体结构而不是平面正方形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②③ | C. | ③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通式为CnH2n | |
| B. | 可以使酸性高锰酸钾溶液褪色 | |
| C. | 在光照下可与氯气发生加成反应 | |
| D. | 随分子中碳原子数的增加,烷烃的熔沸点升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:1 | B. | 6:1:1 | C. | 10:5:1 | D. | 15:5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
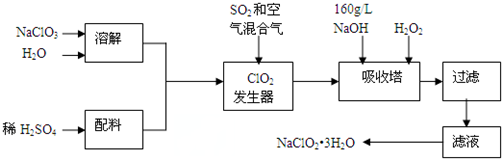
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com