
| NaOH溶液体积/mL(含0.13molNaOH) | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
| m |
| M |
| n |
| V |
| 153×10-3g |
| 17g/mol |
| 9×10-3mol |
| 1L |
| (153-17)mg/L |
| 17g/mol |
| ||
| △ |
| 4L×5 |
| 4×0.20 |
| 4L |
| 4L+25L |
| 5x |
| 4 |
| 3y |
| 4 |
| y |
| 2 |
|
| 0.89 |
| 1 |
|
| 1 |
| 12 |
| 5 |
| 12 |
| 1 |
| 12 |
| 5 |
| 12 |


科目:高中化学 来源: 题型:
| A、共用电子对偏移程度:H-Cl>H-Br |
| B、酸性:HClO4>HBrO4 |
| C、热稳定性:HCl>HBr |
| D、酸性:HCl<HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO).一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子其物质的量(mol)与反应时间t(min)的关系曲线.下列说法错误的是( )
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO).一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子其物质的量(mol)与反应时间t(min)的关系曲线.下列说法错误的是( )| A、工业制取漂白液的化学反应方程式为Cl2+2NaOH═NaCl+NaClO+H2O |
| B、a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+) |
| C、t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-=2Cl-+ClO3- |
| D、使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4、BaCO3都难溶于水,在医学上均可用作“钡餐” |
| B、用浸泡过高锰酸钾溶液的硅藻土保护水源 |
| C、明矾水解时产生具有吸附性的胶体粒子,可用作漂白粉 |
| D、棉花、蛋白质和油脂都是高分子化合物,水解产物均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
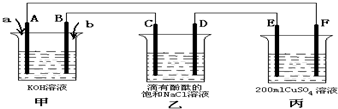
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素X的简单氢化物的沸点<元素W的简单氢化物的沸点 |
| B、元素W的最高价氧化物对应水化物的酸性比Z的弱 |
| C、化合物YX、ZX2、WX3中化学键的类型相同 |
| D、原子半径的大小顺序:rY>rZ>rW>rX |
查看答案和解析>>
科目:高中化学 来源: 题型:
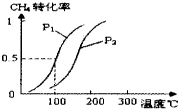 甲醇被称为2l世纪的新型燃料,请解决甲醇的有关问题.
甲醇被称为2l世纪的新型燃料,请解决甲醇的有关问题.| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | ||
| 1 | 150 |
| 0.1 | ||
| 2 |
| 5 | |||
| 3 | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、Mg |
| B、Al、Si |
| C、Al、Mg |
| D、Al、Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com