
| A. | C2H4和C2H4O无论以何种比例混合,只要混合物总质量不变,完全燃烧时生成水的质量也不变 | |
| B. | 甲酸乙酯的结构简式:HC-O-OC2H5 | |
| C. | 汽油、柴油、植物油和甘油都是碳氢化合物 | |
| D. | HCOOCH3和CH3OCHO表示同一种物质 |
分析 A.混合物总质量不变,比例不同,H的质量分数不同;
B.甲酸与乙醇生成甲酸乙酯;
C.植物油为油脂,甘油为丙三醇;
D.HCOOCH3和CH3OCHO均为甲酸甲酯.
解答 解:A.混合物总质量不变,比例不同,H的质量分数不同,则完全燃烧生成水的质量不同,故A错误;
B.甲酸与乙醇生成甲酸乙酯,其结构简式为HCOOC2H5,存在一个C=O键,故B错误;
C.植物油为油脂,甘油为丙三醇,分别为酯类、醇类物质,而汽油、柴油的成分为烃类物质,故C错误;
D.HCOOCH3和CH3OCHO均为甲酸甲酯,表示同一种物质,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、性质及结构为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:解答题
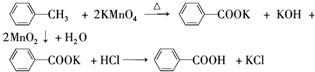
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
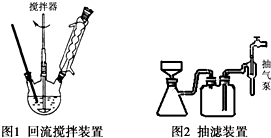
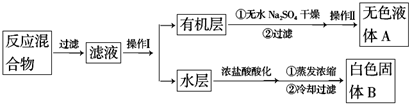
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上制取粗硅的化学方程式:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| B. | 硫酸型酸雨的形成会涉及反应2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| C. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+═SO2+S↓+H2O | |
| D. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2: 2ClO-+CO2+H2O=2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
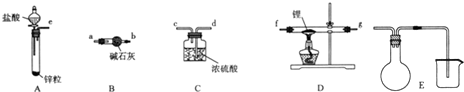
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2→HClO→NaClO | B. | Fe→Fe2O3→Fe(OH)3 | ||
| C. | S→SO3→H2SO4 | D. | NH3→NO2→HNO3→NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中硝酸表现了氧化性和酸性 | |
| B. | 硝酸铵既是氧化产物又是还原产物 | |
| C. | 该反应中被氧化与被还原的物质的质量比为260:63 | |
| D. | 该反应中电子转移数目为8e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com