
化合物F(匹伐他汀)用于高胆固醇血症的治疗,其合成路线如下:

(1)化合物D中官能团的名称为________、________和酯键。
(2)A→B的反应类型是____________。
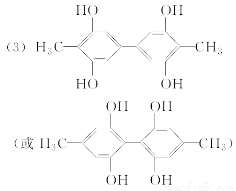
(3)写出同时满足下列条件的A的一种同分异构体的结构简式:________________。
①分子中含有两个苯环;②分子中有3种不同化学环境的氢;③不含—O—O—。
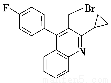
(4)实现D→E的转化中,化合物X的分子式为C19H15NFBr,写出其结构简式:________________。
(5)已知:化合物E在CF3COOH催化作用下先转化为 ,再转化为F。你认为合成路线中设计步骤②的目的是___________________________________________________。
,再转化为F。你认为合成路线中设计步骤②的目的是___________________________________________________。
(6)上述合成路线中,步骤③的产物除D外还生成 ,该反应原理在有机合成中具有广泛应用。试写出以
,该反应原理在有机合成中具有广泛应用。试写出以 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

(1)醚键 醛基 (2)还原反应(或加成反应)
(4) (5)保护羟基,防止被氧化
(5)保护羟基,防止被氧化
(6)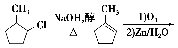
【解析】 (1)根据D物质的键线式,可知其含有的官能团名称为醚键、醛基和酯键。(2)根据A和B物质的键线式比较可知,A→B的反应类型是还原反应。(3)要求对原结构的变动较大,要想准确无误写出要求的结构简式,必须先明确A的不饱和度和碳原子、氧原子个数。整理发现,A不饱和度为8,正好为两个苯环的不饱和度。碳原子个数为14、氧原子个数为4。再根据分子中只能有三种不同化学环境的氢,得知结构必须高度对称。故将两苯环对称放置,两侧各安置1个甲基和2个羟基,且苯环内部也尽量对称(详见参考答案)。(4)书写时注意比较D、E两物质的区别寻找线索(详见参考答案)。(5)从化合物E到化合物F的键线式比较可知,合成路线中设计步骤②的目的是保护羟基,防止被氧化。(6)根据上述合成路线图中的信息可知,欲由五元环结构合成六元环结构需要先开环,再成环。合成路线及条件详见参考答案。


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第4讲物质结构元素周期律练习卷(解析版) 题型:选择题
X、Y是元素周期表中ⅦA族的两种元素,下列能说明X的非金属性比Y强的是( )。
A.电子层数:X>Y
B.气态氢化物的稳定性:HX<HY
C.酸性:HXO4>HYO4
D.能发生置换反应:Y2+2NaX=X2+2NaY
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第15讲实验化学练习卷(解析版) 题型:实验题
苯乙醚是一种无色油状液体,熔点-30 ℃,沸点 172 ℃,不溶于水,易溶于醇和醚,广泛用于有机合成中间体及制造医药、染料等。实验合成的原理为:

主要实验步骤如下:
(Ⅰ)合成:在烧瓶中(装置如图)加入7.53 g苯酚、3.92 g NaOH和4 mL水,开动搅拌器,使固体全部溶解,加热反应器控制温度80~90 ℃之间,并用滴液漏斗慢慢滴加8.59 mL溴乙烷(沸点38.4 ℃),大约40 min滴加完毕,继续搅拌1 h,冷却至室温。

(Ⅱ)分离与提纯。
①加入适量的水(10~15 mL)使固体完全溶解,将液体转入分液漏斗中,分出水相;
②水相用8 mL乙醚萃取一次,与有机相合并;
③有机相用等体积饱和食盐水洗两次,分出水相,再将水相用6 mL乙醚萃取一次,与有机相合并;
④有机相用无水氯化钙干燥;
⑤先用水浴蒸出乙醚,然后常压蒸馏,收集148 ℃稳定的馏分得苯乙醚;
⑥称量产品质量3.69 g。
回答下列问题:
(1)用图示的滴液漏斗代替普通漏斗滴液,其优点是_______________________。
(2)合成时,开动搅拌器的目的是_______________________________。
(3)控制温度80~90 ℃可采用的方法是________________,两次用乙醚萃取的目的是________________________________________________________。
(4)蒸馏时最后温度稳定在148 ℃左右,其原因是_________________
_______________________________________________________。
(5)本次产率为12.4%,产率偏低的原因可能有__________________________
______________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第12讲化学实验基础练习卷(解析版) 题型:实验题
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2·nCuCO3表示。实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:

Ⅰ.废铜屑制硝酸铜
方案1:将铜屑在空气中充分灼烧,残留固体溶于稀硝酸;
方案2:如图1(夹持仪器已省略)。将浓硝酸缓慢加到废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
方案3:将方案2中浓硝酸换成稀硝酸,其他不变。
Ⅱ.碱式碳酸铜的制备
①向大试管中加入碳酸钠溶液和硝酸铜溶液
②水浴加热至70 ℃左右
③用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡、静置、过滤
④用热水洗涤、烘干,得到碱式碳酸铜产品
请回答下列问题:
(1)按方案1实验,必须选择的下列仪器有________(填序号)。

(2)图2中能分别替代图1中B和C装置的是________(填装置序号)。
(3)已知:NO+NO2+2NaOH===2NaNO2+H2O;2NO2+2NaOH===NaNO3+NaNO2+H2O,NO不能单独与NaOH溶液反应,实验结束时,如何操作才能使装置中的有毒气体被NaOH溶液完全吸收?__________________________。
(4)步骤④中洗涤的目的是______________________________________。
(5)步骤③过滤后的滤液中含有CO32—,检验CO32—的方法是_________________________________________________________。
(6)测定碱式碳酸铜组成的方法主要有两种:
方法1 灼烧法:取34.6 g纯净物mCu(OH)2·nCuCO3,在硬质试管里灼烧,将气体产物依次通入足量的浓硫酸、足量的碱石灰中,完全吸收后浓硫酸净增1.8 g,碱石灰净增8.8 g。
方法2 还原法:在氢气中加强热,测反应前后固体的质量。
①利用上述数据推算碱式碳酸铜的化学式_____________________。
②配平化学方程式:mCu(OH)2·nCuCO3+________H2 ________Cu+________CO2↑+________H2O
________Cu+________CO2↑+________H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第12讲化学实验基础练习卷(解析版) 题型:选择题
按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。

下列说法错误的是( )。
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第11讲有机化学基础练习卷(解析版) 题型:选择题
增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得。

下列说法正确的是( )。
A.邻苯二甲酸酐的二氯代物有3种
B.环己醇分子中所有的原子可能共平面
C.DCHP能发生加成、取代、消去反应
D.1 mol DCHP最多可与含2 mol NaOH的溶液反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第10讲金属元素及其化合物练习卷(解析版) 题型:填空题
某研究小组利用工业生产钛白粉产生的废液(含有大量的Fe2+、H+、SO42—和少量的Fe3+、TiO2+)生产乳酸亚铁,其工艺流程如下:
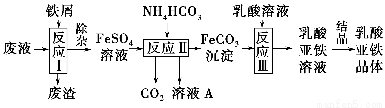
(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+??2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=________。
(2)反应Ⅱ需控制反应温度低于35 ℃,其目的是________________,该反应的化学方程式是________________。检验溶液A中是否含Fe2+的实验操作方法是_________________________________________________________。
(3)已知:FeCO3(s)??Fe2+(aq)+CO32—(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因______________________________________________。
(4)结晶过程必须控制在一定的真空度条件下进行,原因是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练专题12物质结构与性质(选修)练习卷(解析版) 题型:选择题
某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是( )。
A.电子排布式为1s22s22p63s23p63d34s2
B.该元素为V
C.该元素为ⅡA族元素
D.该元素位于d区
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题5化学反应与能量练习卷(解析版) 题型:填空题
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。请回答下列问题:

(1)图中A、C分别表示________、________;
(2)E表示________;E的大小对该反应的反应热________(填“有”或“无”)影响。
(3)该反应通常用V2O5作催化剂,加V2O5会使图ΔH________(填“变大”、“变小”或“不变”),理由是_____________________________________。
(4)图中ΔH=________kJ·mol-1;
(5)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH=________(要求计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com