
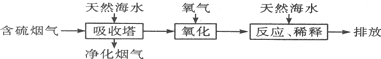
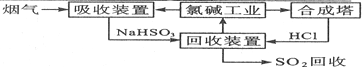
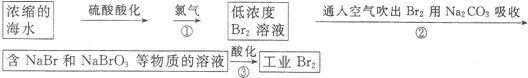
分析 (1)根据氧气将H2SO3氧化来分析;利用酸碱反应分析混合的目的;
(2)①含SO2的烟气,与NaOH反应生成NaHSO3;
②回收装置中NaHSO3溶液与HCl反应生成NaCl溶液,NaCl溶液又是氯碱工业的原料,故循环利用的物质是NaCl溶液;
(3)由流程可知,浓缩后增大溴离子的浓度,与氯气发生2Br-+C12=Br2+2Cl-,用空气将溴吹出,用纯碱溶液吸收,从而达到富集溴,②中发生3Br2+3Na2CO3═5NaBr+3CO2+NaBrO3,③中发生5Br-+6H++BrO3-═3Br2+3H2O,以此来解答;
(4)①石灰乳能将镁离子转化为沉淀;
②用作镁蒸气的冷却剂,应不与Mg反应,以此来解答.
解答 解:(1)氧气将H2SO3氧化为硫酸,该反应为2H2SO3+O2=2H2SO4,氧化后的“海水”需要用大量的天然海水与之混合后才能排放,是因中和稀释经氧气氧化后海水中生成的酸(H+),即NaOH与硫酸发生中和反应,
故答案为:2H2SO3+O2═2H2SO4;NaOH与硫酸发生中和反应;
(2)①氯碱工业产品之一为NaOH,用NaOH吸收SO2,其离子方程式为SO2+OH-=HSO3-,
故答案为:SO2+OH-=HSO3-;
②回收装置中NaHSO3溶液与HCl反应生成NaCl溶液,NaCl溶液又是氯碱工业的原料,故循环利用的物质是NaCl溶液,故答案为:NaCl;
(3)由流程可知,浓缩后增大溴离子的浓度,与氯气发生2Br-+C12=Br2+2Cl-,用空气将溴吹出,用纯碱溶液吸收,从而达到富集溴,②中发生3Br2+3Na2CO3═5NaBr+3CO2+NaBrO3,③中发生5Br-+6H++BrO3-═3Br2+3H2O,
①由上述分析可知,用Na2CO3吸收的目的是富集溴,故答案为:富集溴;
②反应③中发生5Br-+6H++BrO3-═3Br2+3H2O,由NaBrO3中溴元素的化合价降低为5-0=5可知,每生成3mol Br2,转移电子的物质的量是5mol,故答案为:5;
③除去工业Br2中微量的Cl2,不能选碳酸钠、亚硫酸钠,均与溴、氯气反应,a会引入杂质,只有b中NaBr溶液与Cl2反应,然后分液可除去Cl2,故答案为:b;
(4)①石灰乳能将镁离子转化为沉淀,则在母液中加入石灰乳所起的作用是沉淀Mg2+,故答案为:沉淀Mg2+;
②用作镁蒸气的冷却剂,应不与Mg反应,只有A符合,而Mg与二氧化碳、氧气、水蒸气等均可反应,故答案为:A.
点评 本题考查海水资源的综合利用,为高频考点,试题知识点较多、综合性较强,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,为解答该题的关键,题目难度中等,注意(3)③中除杂不能引入新杂质,且易于分离.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| 物质 | 选用试剂(过量) | 操作方法 | |
| A | Cu(CuO) | 氧气 | 通入氧气并加热 |
| B | CO2(HCl) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| C | N2(O2) | 铜粉 | 气体通过炽热的铜粉 |
| D | KCl溶液(K2CO3) | 氯化钙溶液 | 加入氯化钙溶液充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl 加聚反应 | |
| B. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O 酯化反应 | |
| C. | 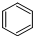 +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$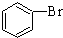 +HBr 加成反应 +HBr 加成反应 | |
| D. | 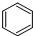 +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$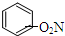 +H2O 取代反应 +H2O 取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,18 g H20所含的中子数为10NA | |
| B. | 一定条件下1 mol铁粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32一)=1 mol•L-1,则Na+数目大于2NA | |
| D. | 含阴阳离子总数为4NA的固体Na202溶于水配成1 L溶液,所得溶液中Na+的物质的量浓度为2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
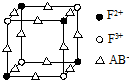 已知A、B、C、D、E、F都是周期表中前 四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前 四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.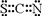 ]-,其中心原子采用sp杂化.
]-,其中心原子采用sp杂化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种溶液中,相关微粒存在如下关系:c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | |
| B. | 三种溶液中离子浓度c(X-)<c(Y-)<c(Z-) | |
| C. | 将三种溶液均加水稀释到1000mL后,三种溶液的pH分别为8、9、10 | |
| D. | HX、HY、HZ的酸性依次增强,电离平衡常数K(HX)>K(HY)>K(HZ) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
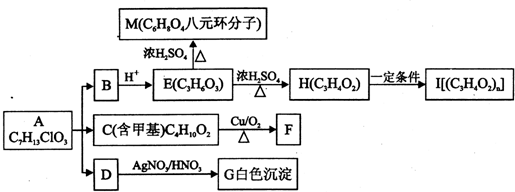
 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$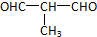 +2H2O.
+2H2O. .
.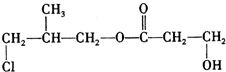
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com