
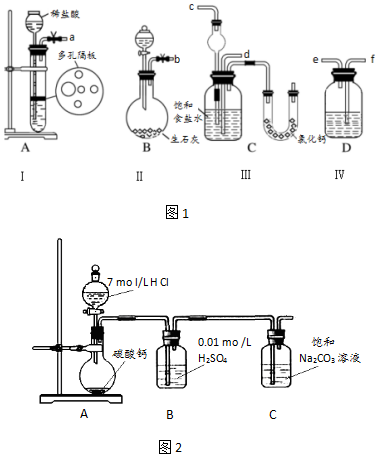
分析 (1)根据装置A制取CO2,装置B制取NH3,装置D除去二氧化碳中的HCl,二氧化碳与氨气通入C中,其中氨气应防止倒吸,据此分析连接仪器装置;
(2)A装置是制备二氧化碳气体一般用碳酸钙和盐酸反应生成,二氧化碳气体中含有氯化氢气体,会影响碳酸氢钠的生成,D为装置除杂可以用饱和碳酸氢钠溶液;
(3)氨气易溶于水,二氧化碳在水中的溶解度较小,制取碳酸氢钠时先要得到含氨的饱和食盐水;
(4)为了析出氯化铵晶体,则向滤液中加入适量的NaCl粉末,提高氯离子浓度,使NH4Cl晶体析出;实验证明所得固体的成分大部分是氯化铵,是利用氯化铵的性质,受热生成氯化氢和氨气气体,在试管口处温度降低重新生成固体氯化铵分析判断;
(5)B中酸可抑制二氧化碳的溶解,且能够吸收二氧化碳中的氯化氢气体;
(6)①Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀;
②样液与BaCl2溶液混合,现白色沉淀并有气体产生,沉淀为碳酸钡、气体为二氧化碳;
(7)氢氧化钠与过量的二氧化碳反应生成碳酸氢钠,也可以用碳酸钠与二氧化碳反应生成碳酸氢钠,据此写出反应的化学方程式.
解答 解:(1)向饱和氯化钠溶液中通入足量的二氧化碳与氨气反应生成NaHCO3沉淀,则装置A产生CO2,装置B产生NH3,装置D除去二氧化碳中的HCl,二氧化碳与氨气通入C中,其中氨气应防止倒吸,则b接c,故a接f、e接d,
故答案为:d、c;
(2)A装置是制备二氧化碳气体的反应,所以Ⅰ中盛放稀盐酸的仪器名称是长颈漏斗,生成的二氧化碳气体中含有氯化氢,若不除去碳酸氢钠难以形成,所以应用饱和碳酸氢钠溶液或饱和氯化钠溶液除去,
故答案为:长颈漏斗;饱和NaHCO3溶液;
(3)候氏制碱方法是利用氨气溶解性大极易溶解于水,二氧化碳气体水中溶解性较小,实验饱和食盐水中先通入氨气,再通入二氧化碳气体;实验操作过程中,应让B装置先发生反应,
故答案为:B;
(4)第四步中为了析出氯化铵晶体,则向滤液中加入适量的NaCl粉末,提高氯离子浓度,使NH4Cl晶体析出;所得的氯化铵晶体中常含有少量的氯化钠和碳酸氢钠(约占5%~8%),设计简单的实验证明所得固体的成分大部分是氯化铵,是利用氯化铵的分解产物为气体,温度降低氨气和氯化氢气体会重新生成固体氯化氨,方法为:取少量样品于试管中,用酒精灯加热,看到试管上端有白烟生成(或试管口有白色晶体),最后剩余极少量的固体,从而证明所得固体的成分大部分是氯化铵;
故答案为:NaCl;取少量固体放入试管中,加热,固体大部分消失,在试管口内壁又有较多的固体凝结;
(5)B中酸可抑制二氧化碳的溶解,则B中溶液的作用为CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体,
故答案为:CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体;
(6)①Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,所以无法确定固体的成分中是否含有NaHCO3,
故答案为:Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3;
②样液与BaCl2溶液混合,现白色沉淀并有气体产生,沉淀为碳酸钡、气体为二氧化碳,离子反应为2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O;
故答案为:2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O;
(7)可以将过量的CO2通入NaOH溶液或Na2CO3中,反应的化学方程式为:NaOH+CO2=NaHCO3或Na2CO3+CO2+H2O=2NaHCO3,
故答案为:NaOH+CO2=NaHCO3或Na2CO3+CO2+H2O=2NaHCO3.
点评 本题考查了纯碱工业原理及其应用,题目难度中等,明确制备流程及常见物质的性质为解答关键,注意掌握侯氏制碱法的反应原理,试题侧重考查学生的分析、理解能力及化学实验能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、SO32- | |
| B. | 室温下,由水电离出来的c(H+)=1×10-14mol•L-1的溶液中:Ba2+、NO3-、K+、ClO- | |
| C. | 能使酚酞变红色的溶液中:Na+、K+、AlO2-、CO32- | |
| D. | 含大量NO3-的溶液:H+、Fe2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
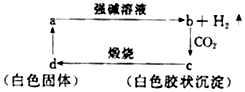
| A. | a在与强碱溶液的反应中氧化剂是强碱 | |
| B. | 向b中滴加适量盐酸可得到c | |
| C. | c不一定是两性物质 | |
| D. | d一定能和氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| C. | 硫酸、烧碱、纯碱、生石灰分别属于酸、碱、盐、氧化物 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硅、锗都位于金属与非金属的交界处,都可以做半导体材料 | |
| B. | 氢化物的沸点:H2O>NH3>HF | |
| C. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| D. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
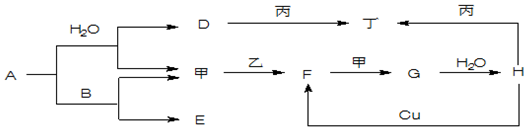
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属阳离子被还原时不一定得到金属单质 | |
| B. | 非金属元素的最高价含氧酸都具有强氧化性 | |
| C. | 由共价键形成的分子一定是共价化合物 | |
| D. | 直径介于1nm~100nm之间的微粒成为胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com