
(18分) (1)某实验小组的甲同学用图l所示装置制取少量乙酸乙酯(加热设备及夹持固定装置均略去)。
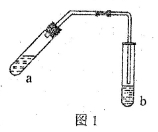

①试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是 。
②试管a中加入碎瓷片的作用是 ,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填序号)。
A.立即补加 B.不需补加 C.冷却后补加 D.重新配料
③实验中加热试管a的目的是:(i) ;(ii) 。
④试管b中盛有饱和Na2CO3溶液,其作用是 。
⑤反应结束后,振荡试管b,静置。观察到的现象是 。
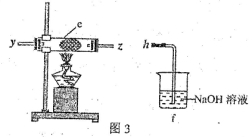
(2)该小组的乙同学利用图2所示装置制备并收集干燥的NO2气体。
①图2中仪器n的名称是 。
②请在方框内画出用集气瓶收集NO2的装置图。
③写出仪器n中发生反应的离子方程式: 。
(3)该小组的丙同学利用图2所示装置制取NH3和O2的混合气体,并且利用图3所示装置验证NH3的某些性质。m中加入浓氨水,q中加入碱石灰,e内放置催化剂(铂石棉),按气流方向连接各仪器x→y→z→h。
①图2仪器n内需加入固体试剂的名称为 。
②实验中观察到e内有红棕色气体出现,证明氨气具有 性,e中发生反应的化学方程式为 。
(1)①先加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸 ②防止暴沸;C
③加快反应速率;及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动
④吸收随乙酸乙酯蒸出的少量乙酸和乙醇 ⑤b中的液体分层,上层是透明的油状液体
(2)①圆底烧瓶 ②
③Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
(3)①过氧化钠 ②还原 ③4NH3+5O2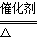 4NO+6H2O、2NO+O2=2NO2
4NO+6H2O、2NO+O2=2NO2
【解析】
试题分析:(1)①浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸。
②液体加热要加碎瓷片,防止暴沸,如果加热一段时间后发现忘记加碎瓷片,应冷却至室温,补加碎瓷片,故答案为:防止暴沸;C。
③实验中加热试管,反应的温度高,反应速度快,该反应为可逆反应,温度高,乙酸乙酯的沸点低,易挥发,所以化学平衡向正反应方向移动,利于生成乙酸乙酯,故答案为:加快反应速率;及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动。
④制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯。
⑤乙酸乙酯,其密度比水小,所以在碳酸钠溶液层上方有无色油状液体出现。
(2)①根据仪器的结构特点可知,图2中仪器n的名称是圆底烧瓶。
②二氧化氮气体易溶于水,所以不能用排水法收集;二氧化氮的密度大于空气的密度且和氧气不反应,所以可以采用向上排空气法收集,另外NO2是大气污染物,需要有尾气吸收装置,则装置图为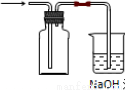 。
。
③铜与浓硝酸反应的离子方程式为Cu+4H++2NO3-=Cu2++2H2O+2NO2↑。
(3)①过氧化钠与H2O反应生成氢氧化钠和氧气,同时放出大量热,温度升高使浓氨水中氨的溶解度减小而逸出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;②氨气中氮元素的化合价是-3价,二氧化氮中氮元素的化合价是+4价,反应前后氮元素的化合价升高,所以氨气作还原剂,体现其还原性;氨气和氧气在一定条件下反应生成一氧化氮和水,一氧化氮和氧气能反应生成二氧化氮,反应方程式为:4NH3+5O2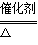 4NO+6H2O、2NO+O2=2NO2。
4NO+6H2O、2NO+O2=2NO2。
考点:考查乙酸乙酯和NO2制备的实验方案设计与评价


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014天津市高三第五次月考理综化学试卷(解析版) 题型:选择题
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成下图所示的原电池。下列判断不正确的是
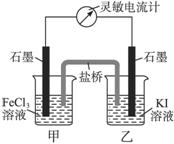
 A. 为证明反应的发生,可取甲中溶液加入酸性高锰酸钾溶液
A. 为证明反应的发生,可取甲中溶液加入酸性高锰酸钾溶液
B. 反应开始时,甲中石墨电极上Fe3+被还原,乙中石墨电极上发生氧化反应
C. 电流计读数为零时,在甲中加入FeCl2固体后,甲中石墨电极为负极
D. 此反应正反应方向若为放热反应,电流计读数为零时,降低温度后,乙中石墨电极为负极
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列叙述正确的是________________。
A.不慎把苯酚溶液沾到了皮肤上,应立即用酒精洗涤
B.甲、乙两种有机物具有相同的相对分子质量和不同结构,则甲和乙一定是同分异构体。
C.将浓溴水滴入到苯酚溶液中立即产生2,4,6-三溴苯酚的白色沉淀。
D.将CH3CHO(易溶于水,沸点为20.8℃的液体)和CH3COOH分离的最好的方法是直接蒸馏
E.水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精
F.实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃。
G.除去混在苯中的少量苯酚,加入过量溴水,过滤。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列鉴别方法不可行的是
A.用水鉴别1-丙醇、甲苯和硝基苯
B.用燃烧法鉴别甲醇、苯和四氯化碳
C.用饱和碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
D.用溴水鉴别乙苯、苯酚、环己烷和乙醇
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列有关甲苯的实验事实中,能说明苯环对侧链性质产生影响的是
A.甲苯燃烧产生带浓烟的火焰 B.甲苯能使酸性KMnO4溶液褪色
C.甲苯的硝化反应生成三硝基甲苯 D.甲苯能与H2发生加成反应
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市南开区高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
用电动公交车初步替代燃油公交车是天津市节能减排、控制雾霾的重要举措之一。Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,有关该电池的下列说法中,正确的是
A.电池反应的化学方程式为:2Li+FeS=Li2S+Fe
B.负极的电极反应式为:Al-3e-=Al3+
C.Li—Al在电池中作为负极材料,该材料中Li的化合价是+1
D.电池充电时,阴极反应为:Li2S+Fe-2e-=2Li++FeS
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市南开区高三二模试卷理综化学试卷(解析版) 题型:填空题
(14分)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。
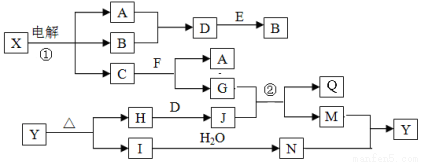
已知A、B为气态单质,F是地壳中含量最多的金属元素的单质:E、H、I为氧化物,E为黑色固体,H为红棕色粉末,I为红棕色气体;M为红褐色沉淀,Q为白色胶状物质。
请回答下列问题:
(1)组成单质F的元素在周期表中的位置是______;C中存在的化学键类型为____;E的化学式是___。
(2)A在B中燃烧的现象是_______ 。
(3) D+E→B的反应中,被氧化与被还原的物质的物质的量之比是_______。
(4)反应①的化学方程式为___________________________________ 。
(5)反应②的离子方程式为___________________________________。
(6)Y受热分解可生成H、I和氧气,.写出该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市东丽区第一学期期末质量监测高一年级化学试卷(解析版) 题型:简答题
(6分) 向1L AlCl3和FeCl3混合溶液中加入2mol /LNaOH溶液300mL时,产生的沉淀量达最大值;继续加入NaOH溶液,沉淀开始溶解,当加入NaOH溶液的总体积达到 350mL时,沉淀不再减少,求原溶液中FeCl3的物质的量浓度(需写出解题过程)。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高二下学期期末考试化学试卷(解析版) 题型:选择题
只用一种试剂就可鉴别:C2H5OH、NaOH、C6H5OH、AgNO3、Na2CO3、KI六种透明溶液,这种试剂是
A.稀盐酸 B.氯化铝溶液
C.溴 水 D.酸性高锰酸钾溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com