
| A. | NaHCO3、NaOH、Mg(OH)2 | B. | NaHCO3、Na2CO3、MgCO3 | ||
| C. | NaHCO3、MgCO3、Al(OH)3 | D. | Na2CO3、MgCO3、CaO |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)═c(A-)+c(Cl-) | |
| D. | 在25℃100 mL NH4Cl溶液中:c(Cl-)═c(NH4+)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(SO2)=4 mol/(L•min) | B. | v(O2)=3 mol/(L•min) | ||
| C. | v(SO3)=6 mol/(L•min) | D. | v(O2)=6 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱、石灰石、石英、铁屑 | B. | 纯碱、石灰石、石英 | ||
| C. | 碳酸钾、石灰石、石英 | D. | 水玻璃、石灰石、石英、氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
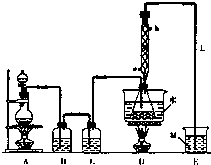 S2Cl2是工业常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:
S2Cl2是工业常用的硫化剂,广泛应用于石油化工.实验室制备S2Cl2的方法有两种:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | 一109 | 一23 | -77 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com