
| A. | 乙酸的结构简式:C2H4O2 | |
| B. | 乙烯的电子式: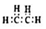 | |
| C. | 硫离子结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2 |
分析 A.乙酸含有羧基,C2H4O2为分子式;
B.乙烯含有碳碳双键;
C.硫离子核外有3个电子层,最外层电子数为8;
D.Ba(OH)2电离出2个OH-.
解答 解:A.乙酸结构简式为CH3COOH,C2H4O2为分子式,故A错误;
B.乙烯含有碳碳双键,电子式为 ,故B错误;
,故B错误;
C.硫离子核外有3个电子层,最外层电子数为8,硫离子结构示意图为 ,故C正确;
,故C正确;
D.Ba(OH)2电离出2个OH-,电离方程式为Ba(OH)2=Ba2++2OH-,故D错误.
故选C.
点评 本题综合考查化学用于知识,为高频考点和常见题型,侧重考查双基的掌握,有利于培养学生的良好的学生素养,注意把握电子式、结构简式、原子结构示意图以及电离方程式的书写,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈红色的溶液中:S2O32-、Al3+、C2O42-、SO42- | |
| B. | Kw/c(H+ )=0.1mol•L-1的溶液:K+、Na+、CO32-、NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| D. | 无色溶液中:Cr2O72-、NH4+、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
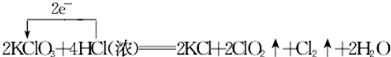 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 硫酸的电离方程式:H2SO4═2H++SO42- | |
| C. | S2-的结构示意图: | |
| D. | 明矾的化学式:KAl(SO4)2•12H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇可以使蛋白质变性,常用于食品保鲜 | |
| B. | 氧化铝熔点高,常用子制造耐火材枓 | |
| C. | 氧化钠可用作呼吸面具中的供氧剂 | |
| D. | 常温下,可用铁槽车或铝槽车运输稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A. | 增加Fe2O3固体可以提高CO的转化率 | |
| B. | 减小容器体积既能提高反应速率又能提高平衡转化率 | |
| C. | 该反应的正反应△H<0 | |
| D. | 当容器内气体密度恒定时,不标志该反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com