
以NA表示阿伏伽德罗常数,下列说法正确的是()
A. 0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA
B. 0.1mol Na2SO4溶液中,含有SO42﹣数为0.1NA
C. 46gNO2和N2O4混合气体中,含有氧原子总数为3NA
D. 0.5L 1mol/LNaCl溶液中含有的钠离子浓度1mol/L
考点: 阿伏加德罗常数.
分析: A.铁与盐酸反应生成二价铁离子;
B.硫酸钠为强电解质,在水中完全电离;
C.质量换算物质的量结合NO2和N2O4混合气体氮元素和氧元素质量比相同计算判断;
D.从氯化钠完全电离分析.
解答: 解:A.0.1mol Fe与足量盐酸反应生成氯化亚铁,转移的电子数为0.2NA,故A错误;
B.硫酸钠为强电解质,0.1mol Na2SO4在水中完全电离生成0.1mol硫酸根离子,故B正确;
C.46gNO2和N2O4混合气体中,二氧化氮和四氧化二氮最简比相同为NO2,所以计算46gNO2中所含原子数即可,含原子数= =3mol,故C正确;
=3mol,故C正确;
D.NaCl=Na++Cl﹣,所以钠离子物质的量与氯化钠的物质的量相同,同一溶液中浓度相同,故D正确;
故选:BC.
点评: 本题考查了阿伏伽德罗常数的应用,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,熟悉强电解质电离方式是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
常温下,0.1mol/L某一元酸(HA)溶液中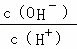 =1×10﹣8,下列叙述正确的是( )
=1×10﹣8,下列叙述正确的是( )
|
| A. | 溶液中水电离出的c(H+)=10﹣10mol/L |
|
| B. | 溶液中c(H+)+c(A﹣)=0.1 mol/L |
|
| C. | 溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH﹣)均增大 |
|
| D. | 与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A﹣)>c(Na+)>c(OH﹣)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2﹣、dZ﹣都具有相同的电子层结构,下列关系正确的是()
A. 质子数c>b B. 离子的还原性Y2﹣>Z﹣
C. 氢化物的稳定性H2Y>HZ D. 原子半径X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是()
A. 含金属元素的离子一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从化合态变为游离态时,该元素一定被还原
D. 金属阳离子被还原不一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
分类方法在化学学科发展中起到了非常重要的作用.下列分类标准合理的是()
①根据其溶液是否导电,将物质分为电解质和非电解质
②依据反应中有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
③根据反应是否有离子参加将反应分为离子反应和非离子反应
④根据组成元素的种类,将纯净物分为单质和化合物
⑤根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体.
A. ①②③④ B. ②③④⑤ C. ②③④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Br2+SO2+2H2O=H2SO2+2HBr相比较,水的作用相同的是()
A. 电解水:2H20=2H2↑+O2↑ B. 4Fe(OH)2+O2+2H2O=4Fe(OH)3
C. 2F2+H2O=4HF+O2 D. 3NO2+H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等
B. 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
C. 过程的自发性不仅能用于判断过程的方向,还能确定过程是否一定能发生
D. S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
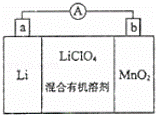
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原 理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
(1)外电路的电流方向是由b极流向 极(填字母).
(2)电池正极反应式 .
(3)是否可用水代替电池中的混合有机溶剂?否(填“是”或“否”),原因是 .
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为 .K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知3.0g AO32﹣中核外电子数比质子数多6.02×1022个,下列说法中正确的是( )
|
| A. | A原子的摩尔质量32g/mol |
|
| B. | AO32﹣的摩尔质量为60 |
|
| C. | 3.0g AO32﹣ 的物质的量是0.02mol |
|
| D. | A元素的相对原子质量为12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com