
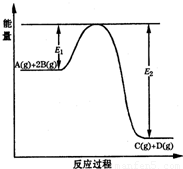
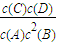 ;反应是吸热反应,加热平衡逆向进行,平衡常数减小,
;反应是吸热反应,加热平衡逆向进行,平衡常数减小,

科目:高中化学 来源: 题型:
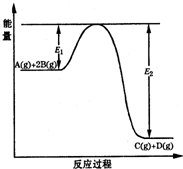 某可逆反应的反应过程中能量变化如图所示,回答下列问题.
某可逆反应的反应过程中能量变化如图所示,回答下列问题.| c(C)c(D) |
| c(A)c2(B) |
| c(C)c(D) |
| c(A)c2(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:
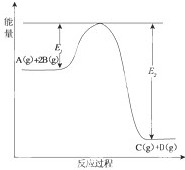 某可逆反应的反应过程中能量变化如图所示,回答下列问题.
某可逆反应的反应过程中能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、在一定条件下,某可逆反应的△H=+100kJ?mol-1,则该反应正反应活化能比逆反应活化能大100kJ?mol-1 | B、图中A、B曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0未使用和使用催化剂时,反应过程中的能量变化 | C、同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 | D、己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2.则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某可逆反应的反应过程中能量变化如下图所示,回答下列问题。
(1)若E1=215kJ?mol-1,E2=625kJ?mol-1,则该反应的热化学方程式为 。
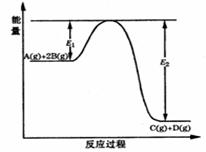 (2)当反应达到平衡时,降低温度,A的转化率
(2)当反应达到平衡时,降低温度,A的转化率
(填“增大”“减小”或“不变”),原因 是 。
(3)该反应的平衡常数表达式为K= ,升高温度平衡常数K (填“增大”、“减小”、“不变”或“可能增大,也可能减小”)。
(4)在反应体系中加入催化剂,反应速率增大,则 (用字母代号填空)。
A.E1减小,E2减小,反应热不变 B.E1减小,E2减小,反应热减小
C.E1减小,E2增大,反应热减小 D.E1增大,E2增大,反应热增大
(5)在一个容积不变的容器中加入一定量的A和B发生上述反应,下列图像符合该反
应的是____ (填序号)(图中v是速率、∅为气体D的体积分数,T为温度)
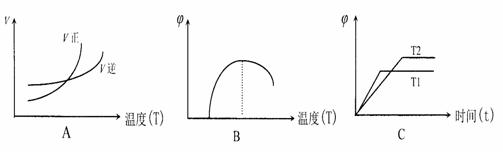
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com