
【题目】常温下,将HC1气体通入到1L浓度均为0.1mol/L的NaA和NaB的混合溶液中,混合溶液的pH与离子浓度变化的关系如图所示(忽略溶液体积的变化)。下列叙述不正确的是
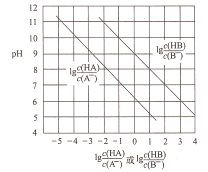
A. Ka(HB)的数量级为10-9
B. 酸性的强弱顺序为HCl>HA>HB
C. 当通入0.1molHC1气体时,c(B-)>c(A-)
D. 当混合溶液呈中性时,c(Na+)=c(Cl-)+c(A-)+c(B-)
【答案】C
【解析】A、根据图像可知,当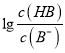 =3时,pH=6,此时,c(H+)=10-6mol/L,
=3时,pH=6,此时,c(H+)=10-6mol/L, 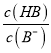 =103,Ka(HB)=
=103,Ka(HB)= 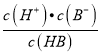 = 10-6×10-3=10-9,故A正确;B、pH一定时,
= 10-6×10-3=10-9,故A正确;B、pH一定时, 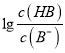 >
>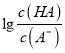 ,则有
,则有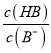 >
>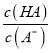 ,
, 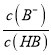 <
<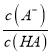 ,式子两边都乘以c(H+),可得
,式子两边都乘以c(H+),可得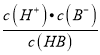 <
<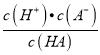 ,即Ka(HB)<Ka(HA),所以酸性HA>HB,向NaA和NaB的混合溶液中通入HCl后,溶液中存在HA、HB,则说明HCl酸性强于HA和HB,所以酸性强弱顺序为HCl>HA>HB,故B正确;C、原溶液中NaA和NaB均为0.1mol,根据强酸制弱酸原理,通入0.1molHCl,H+先与B-反应,反应后溶液中溶质为0.1molNaA、0.1molNaCl、0.1molHB,NaA完全电离,微弱水解,而HB部分电离,所以溶液中c(B-<c(A-),故C错误;D、混合溶液的电荷守恒为:c(Na+)+c(H+)=c(Cl-)+c(A-)+c(B-)+c(OH-),当溶液呈中性时,c(H+)= c(OH-),所以有c(Na+)+c(H+)=c(Cl-)+c(A-)+c(B-)+c(OH-),故D正确。故选C。
,即Ka(HB)<Ka(HA),所以酸性HA>HB,向NaA和NaB的混合溶液中通入HCl后,溶液中存在HA、HB,则说明HCl酸性强于HA和HB,所以酸性强弱顺序为HCl>HA>HB,故B正确;C、原溶液中NaA和NaB均为0.1mol,根据强酸制弱酸原理,通入0.1molHCl,H+先与B-反应,反应后溶液中溶质为0.1molNaA、0.1molNaCl、0.1molHB,NaA完全电离,微弱水解,而HB部分电离,所以溶液中c(B-<c(A-),故C错误;D、混合溶液的电荷守恒为:c(Na+)+c(H+)=c(Cl-)+c(A-)+c(B-)+c(OH-),当溶液呈中性时,c(H+)= c(OH-),所以有c(Na+)+c(H+)=c(Cl-)+c(A-)+c(B-)+c(OH-),故D正确。故选C。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间
浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
(Ⅰ)无催化剂、不加热 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 |
(Ⅱ)无催化剂、加热 | 360 | 480 | 540 | 720 |
(Ⅲ)MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
该小组在设计方案时,考虑了浓度、a:___________b:___________等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:_____________。
(2)将质量相同但颗粒大小不同的MnO2分别加入到5 mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂 (MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生反应的化学方程式:______________________。
②实验结果说明催化剂作用的大小与________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以 H3AsO3 形式存在)含量极高,为控制砷的排放, 某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多 2 个电子层,砷在元素周期表的位置为_____。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反 应的离子方程式为_____。
(2)电镀厂的废水中含有的 CN-有剧毒,需要处理加以排放。处理含 CN-废水的方法之一是在 微生物的作用下,CN-被氧气氧化成 HCO3- ,同时生成 NH3,该反应的离子方程式为_____。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子, A―表示乳酸根离子):
①阳极的电极反应式为_____
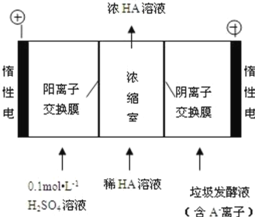
②电解过程中,采取一定的措施可控制阳极室的 pH 约为 6~8,此时进入浓缩室的 OH-可忽略不 计。400 mL 10 g·L-1 乳酸溶液通电一段时间后, 浓度上升为 145 g/L(溶液体积变化忽略不计),阴极上产生的 H2 在标准状况下的体积约为_____L (已知:乳酸的摩尔质量为 90 g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______
(2)D元素位于周期表中___________周期____________族
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)电子式表示化合物 C2D 的形成过程:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取9.0g A,升温使其汽化,测其密度是相同条件下氢气的45倍。 | (1)A的相对分子质量为:_____。 |
(2)将此9.0g A在足量纯氧气中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______。 |
(3)另取9.0g A,跟足量的碳酸氢钠粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L氢气(标准状况)。 | (3)写出A中含有的官能团:____、_____。 |
(4)A的核磁共振氢谱如图:
| (4)A中含有______种氢原子。 |
(5)综上所述A的结构简式__________。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用CO和H2合成甲醇,反应方程式为:
CO (g) +2H2 (g) ![]() CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。
CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图1所示。

(1)当起始n (H2):n(CO) =2,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率v(H2)=____。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH (g),达新平衡时H2的转化率将_______(选填“增大”、“减小”或“不变”)。
(2)当起始n (H2):n(CO) =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_____点(选填“D”、“E”或“F”)。
(3)由图2可知该反应的△H_____0(选填“>”、“<”或“=”,下同),压强pl____p2;当压强为p2时,在y点:v(正)____v(逆)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的变化关系如图所示:
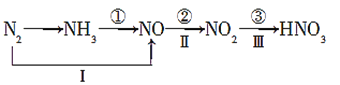
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.反应③中,NO2作氧化剂,H2O作还原剂
D.液氨可用作制冷剂,硝酸可用于制化肥、农药、炸药、染料、盐类等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应N2+3H2![]() 2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )
2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是( )
A.v正(N2)=v逆(NH3)B.3v正(N2)=v正(H2)
C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) ΔH=-a kJ·mol1(a>0),其反应机理如下
2NOBr(g) ΔH=-a kJ·mol1(a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快
NOBr2(g) 快
②NO(g)+NOBr2(g) ![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 增大Br2(g)浓度能增大活化分子百分数,加快反应速率
D. 正反应的活化能比逆反应的活化能小a kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com