
| A. | 对该反应体系加热 | B. | 加入少量NaCl溶液 | ||
| C. | 不用锌片,改用锌粉 | D. | 加入少量1 mol•L-1硫酸 |
科目:高中化学 来源: 题型:选择题
| A. | 在2 min末的反应速率,用B表示是 0.3 mol/(L•min) | |
| B. | 用A表示的反应速率是0.4 mol/(L•min) | |
| C. | 若乙容器中也同时进行此反应,且相同时间段内用D表示的速率是0.2 mol/(L•min),则乙容器中反应速率更快 | |
| D. | 对甲容器升高温度,则正反应速率将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国国家标准( GB2760 )规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
我国国家标准( GB2760 )规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
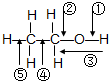 乙醇分子结构中,各种化学键如图所示.乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子结构中,各种化学键如图所示.乙醇在各种反应中断裂键的说明不正确的是( )| A. | 在Cu催化下和O2反应时断裂①,③键 | B. | 和金属钠反应时断裂键① | ||
| C. | 完全燃烧时全部断裂 | D. | 与浓H2SO4共热170℃时断裂键②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用BaCl2 溶液可证明Na2CO3溶液显碱性时由于CO32-发生水解 | |
| B. | NaHCO3 溶液中存在:c(Na+ )=c(HCO3-)+c(CO3 2-) | |
| C. | CH3COOH溶液中加入少量CH3COONa 固体后溶液中c(H+)•c(CH3COO-)增大 | |
| D. | 相同温度下,Ksp较小的物质其溶解度也一定较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下,单质为双原子分子,分子中含有3对共用电子对,其简单氢化物的水溶液显碱性 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小的,其氧化物呈两性 |
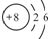 ;
;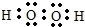 ,元素Z最高价氧化物的水化物与元素Y的最高价氧化物的水化物的溶液相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
,元素Z最高价氧化物的水化物与元素Y的最高价氧化物的水化物的溶液相互反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶液 | B. | 碳酸氢钠溶液 | C. | 碳酸钠溶液 | D. | 醋酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com