
分析 (1)根据盖斯定律将三个化学方程式进行处理,根据盖斯定律①×2-②+③得;
(2)利用盖斯定律可以解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得.物质的能量越低越稳定;
(3)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,计算1mol C6H6(l)完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式;
解答 解:(1)根据盖斯定律①×2-②+③得TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=(-393.5kJ•mol-1)×2-(-566kJ•mol-1)+(+141kJ•mol-1),
即TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=-80kJ/mol,
故答案为:-80 kJ•mol?-1 ;
(2)已知:P4(s,白磷)+5O2(g)═P4O10(s)△H=-2983.2kJ•mol-1 ①,
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H=-738.5kJ•mol-1 ②,
据盖斯定律,①-②×4可得:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1
从上面的热化学方程式可见,相同状况下,白磷比红磷能量高;因为能量越低越稳定,所以红磷比白磷稳定.
故答案为:P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1; 红磷; 低;
(3)1.00g C6H6(l)在O2中完全燃烧生成CO2(g)和H2O(l),放出41.8kJ的热量,则1molC6H6(l)在氧气中完全燃烧放出的热量为41.8×78=3260.4KJ,因此C6H6(l)的燃烧热为△H=-3260.4kJ/mol;C6H6(l)燃烧热的热化学方程式为C6H6(l)+$\frac{15}{2}$O2(g)═6CO2(g)+3H2O(l)△H=-3 260.4 kJ/mol,
故答案为:3260.4kJ/mol;C6H6(l)+$\frac{15}{2}$O2(g)═6CO2(g)+3H2O(l)△H=-3 260.4 kJ/mol.
点评 本题考查反应热的计算,盖斯定律求反应热,题目难度不大,注意盖斯定律的应用,掌握基础是解题关键.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯制备硝基苯: | |
| B. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 乙醇通入热的氧化铜中:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
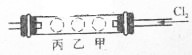 如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是:
如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则:2H+(aq)+SO${\;}_{\;}^{2-}4$(aq)+Ba2+(aq)+2OH-(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1, 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖的燃烧热是2 800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1 400 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时容器内的压强是原来的0.8倍 | |
| B. | M的平均反应速率为0.15 mol•L-1•min-1 | |
| C. | x的值为1 | |
| D. | 平衡时P的浓度为0.25 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com