
| A、CF2Cl2 |
| B、C6H12O6 |
| C、C12H22O11 |
| D、C2H4O2 |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
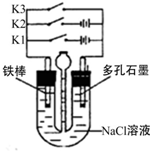
| A、只接通K3,一段时间后,漏斗液面上升 |
| B、只接通K1,一段时间后,U形管中出现白色沉淀 |
| C、只接通K2,U形管左、右两端液面均下降 |
| D、铁腐蚀的速度由大到小的顺序是:只接通K1>只接通K3>都断开>只接通K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | ||||
B、等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合:Ca2++2HC
| ||||
C、用氢氧化钠溶液吸收少量二氧化碳:2OH-+CO2=C
| ||||
| D、将CO2通入次氯酸钙溶液可生成次氯酸:CO2+H2O+Ca2++2ClO-=CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,平衡一定逆向移动 |
| B、若正反应是放热反应,则A为气态 |
| C、物质A一定为非气态,且正反应是吸热反应 |
| D、A可能为气态或非气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝与稀盐酸反应:Al2O3+6H+=2Al3++3H2O |
| B、氯化铵溶液与氢氧化钠溶液共热:NH4++OH-═NH3?H2O |
| C、碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- |
| D、硫酸亚铁溶液中加双氧水:Fe2++2H2O2+4 H+=Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3种溶液pH的大小顺序是 ①>②>③ |
| B、若将3种溶液稀释相同倍数,pH变化最大的是③ |
| C、若分别加入25mL0.1mol?L-1盐酸后,pH最大的是② |
| D、若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A、L2+与R2-的核外电子数相等 |
| B、M与T形成的化合物具有两性 |
| C、气态氢化物的稳定性为H2T<H2R |
| D、L和M金属性强弱比较:L>M |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com