
 ③实验过程中取出盐桥,原电池仍继续工作
③实验过程中取出盐桥,原电池仍继续工作| A.①② | B.②③ | C.②④ | D.③④ |
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源:不详 题型:单选题
| A.MnO2发生了氧化反应 |
| B.MnOOH中Mn元素的化合价为+3 |
| C.反应消耗 0.65gZn,有0.01 mol电子发生转移 |
| D.电池正极的反应为:Zn + 2 OH-–2e-===Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Pb(s)+PbO2(s)+2H2SO4(aq),下面是关于铅蓄电池的一些说法:
Pb(s)+PbO2(s)+2H2SO4(aq),下面是关于铅蓄电池的一些说法:| A.①③⑤ | B.②④⑥ | C.③⑤⑥ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正极材料为锂,负极材料为V2O5 |
| B.向外供电时,锂离子在凝胶中向正极移动 |
| C.正极的电极反应式为:V2O5 + xLi++ xe—="=" LixV2O5 |
| D.负极的电极反应式为:xLi—xe—==xLi+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
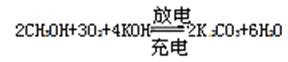
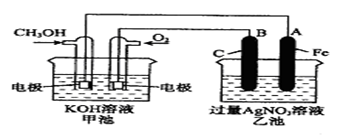
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1 2NO2(g) ΔH=—113.0 kJ·mol-1
2NO2(g) ΔH=—113.0 kJ·mol-1 SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5 : 2 | B.3 : 1 | C.15 : 2 | D.1 : 3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 烧杯号 | V氨水 (mL) | V水(mL) | c (NH3·H2O)(mol·L-1) | c(OH-) | Kb | α |
| 1 | 50.00 | 0.00 | | 1.34×10-3 | | |
| 2 | 25.00 | 25.00 | | 9.48×10-4 | | |
| 3 | 5.00 | 45.00 | | 4.24×10-4 | | |
 ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。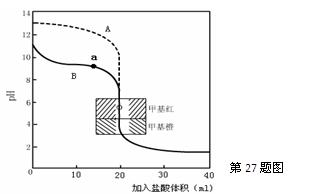
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Ni(OH)2+Cd(OH)
2Ni(OH)2+Cd(OH) 2以下说法中正确的是:( )
2以下说法中正确的是:( )| A.以上反应是可逆反应 |
| B.放电时,镉为正极 |
| C.充电时电池上标有“+”号的电极连接电源负极 |
| D.以镍镉电池为电源,电解Na2CO3溶液,当收集到气体的总体积为33.6L(标况下)时,电池中转移了2mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com