
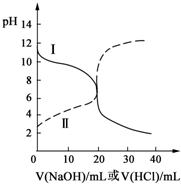
 25℃时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol?L-1的醋酸溶液和氨水溶液各20mL,分别用0.1mol?L-1NaOH溶液、0.1mol?L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A、曲线Ⅰ:滴加溶液到10mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B、曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D、曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |


科目:高中化学 来源: 题型:
- 3 |
2- 4 |
- 3 |
2- 4 |
c(N
| ||
| c(Pb2+) |
c(N
| ||
| c(Pb2+) |
| 离 子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg?L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg?L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2O |
| B、N2O5 |
| C、NO2 |
| D、NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙酸与碳酸钠溶液反应:2H++CO
| ||||
B、油脂在碱性溶液中水解: | ||||
C、苯酚钠溶液中通入二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+
| ||||
D、乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极反应为:C2H6+18OH--14e-═2CO32-+12H2O |
| B、电池的总反应为:2C2H6+7O2═4CO2+6H2O |
| C、放电一段时间后,正极附近溶液的pH降低 |
| D、每消耗1mol C2H6,电池中就消耗4mol KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时,负极的电极反应式为:Pb-2e-═Pb2+ |
| B、放电时,正极得电子的物质是PbO2 |
| C、充电时,电解质溶液中硫酸浓度减小 |
| D、充电时,阴极的电极反应式为:PbSO4-2e-+2H2O═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、把铜片放入浓硫酸中并加热Cu+4H++S
| ||
B、碳酸钙与盐酸反应C
| ||
C、碳酸氢钠溶液和过量盐酸混合HCO
| ||
D、硫酸铜溶液与氢氧化钡溶液反应Ba2++OH-+H++S
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com