
【题目】利用如图装置可验证同主族元素非金属性的变化规律
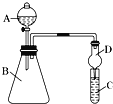
(1)仪器B的名称为__________,干燥管D的作用为__________;
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,C溶液中的离子方程式为_____________,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用______________________溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加________(写化学式)溶液,若观察到C中出现白色沉淀,即可证明,但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有__________溶液的___________(填装置名称)。
【答案】锥形瓶 防止倒吸 Cl2+2I-=2Cl-+I2 NaOH Na2SiO3 饱和NaHCO3 洗气瓶
【解析】
(1)仪器B的名称为锥形瓶;尾气处理装置中,有缓冲装置的能防止倒吸;
(2)浓盐酸和高锰酸钾发生氧化还原反应生成Cl2,Cl2具有氧化性,能氧化I-生成I2,碘遇淀粉试液变蓝色;Cl2和碱反应生成盐,可以用碱液吸收氯气;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸。
(1)根据装置图可知仪器B的名称为锥形瓶;当进入试管的气体被吸收时,导致导气管内的气体压强减小,溶液进入到干燥管中,干燥管内部口径大,可以容纳较多量的溶液,这时干燥管底部脱离试管内液面,液体流回到试管中,能防止倒吸现象的发生,即干燥管有缓冲作用,所以能防止倒吸;
(2)浓盐酸和高锰酸钾发生氧化还原反应生成Cl2,Cl2具有氧化性,能氧化I-生成I2,碘单质遇淀粉试液变蓝色,反应的离子方程式为:Cl2+2I-=2Cl-+I2;氯气是有毒气体,会导致大气污染,从环境保护的观点考虑,此装置缺少尾气处理装置,可用Cl2与强碱反应产生可溶性的盐的性质,可以用碱液吸收氯气,如NaOH溶液作吸收剂;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,若要证明非金属性:C>Si,只要证明碳酸酸性大于硅酸即可,所以A中加入HCl溶液,B中加碳酸钙、C中加入可溶性硅酸盐Na2SiO3溶液,发生反应:CO2+H2O+Na2SiO3= Na2CO3+H2SiO3↓;当硅酸钠溶液中产生白色沉淀说明生成硅酸,证明酸性碳酸强于硅酸;但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有一个除去CO2气体中混有的HCl杂质的洗气瓶,可以用盛有饱和NaHCO3溶液的洗气瓶,发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,达到除杂净化的目的。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知H-H键、Cl-Cl键和H-Cl键的键能分别为436kJ·mol-1、243kJ·mol-1和431kJ·mol-1,则由Cl2(g)和H2(g)反应生成1molHCl(g)时的能量变化是:
A. 放热183kJ B. 放热91.5kJ C. 吸热183kJ D. 吸热91.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂(Li)是世界上最轻的金属,它属于碱金属的一种。下列说法正确的是( )
A. 碱金属单质在氧气中燃烧,都生成过氧化物 B. Li是碱金属原子中半径最小的原子
C. Li、Na、K、Rb+ 的最外层都只有一个电子 D. Na+ 比Li多一个电子层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+ D(g),经2minB的浓度减少0.6mol/L。对此反应速率的表示正确的是
2C(g)+ D(g),经2minB的浓度减少0.6mol/L。对此反应速率的表示正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 分别用B、C、D表示的反应速率其比值是3:2:1
C. 在2min末的反应速率,用B表示是0.3mol/(L·min)
D. 在这2min内用B和C表示的反应速率的值都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
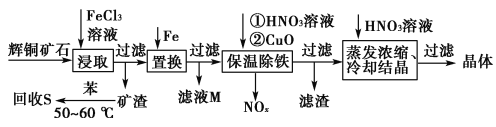
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:______________________________________________________________。
(2)“回收S”过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是______________________________________________________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为_________________________________________________;
向滤液M中加入(或通入)________(填字母),可得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)“保温除铁”过程中,加入CuO的目的是__________;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A1-MnO4电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示。已知电池总反应为Al + MnO4 ═AlO2- + MnO2.下列说法正确的是( )

A. 电池工作时,K+向负极移动
B. 电池工作时,电子由Al经电解质溶液流向Ni
C. 负极反应为Al- 3e + 4OH ═AlO2 + 2H2O
D. 电池工作时,Ni电极周围溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(C8H8)、棱晶烷(C6H6)是近年来运用有机合成的方法制备的,具有如下图所示立体结构的环状有机物。萜类化合物是广泛存在于动植物体内的一类有机物(例如盆烯、月桂烯、柠檬烯等)。
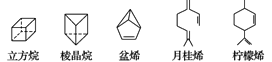
对上述有机物的下列说法中正确的是( )
①盆烯、月桂烯、柠檬烯都能使溴水褪色
②棱晶烷、盆烯与苯互为同分异构体
③月桂烯、柠檬烯互为同分异构体
④立方烷、棱晶烷是环烷烃的同系物
A. ①②③ B. ①②④ C. ①③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
(2)反应①达平衡后采取下列措施,能提高CH3OH产率的有__________。
A.加入H2 B.升高温度 C.增大压强 D.使用催化剂
(3)在一定温度下,将4mol CO和4mol H2混合置于2L的密闭容器中发生反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
(4)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
A. 氢气和二氧化碳的浓度之比为3∶1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(5)二甲醚燃料电池的工作原理如图所示:
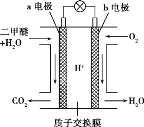
该电池负极的电极反应式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com