
【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
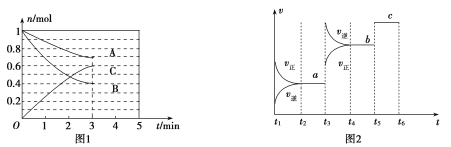
(1)该反应的化学方程式为_____________,此反应平衡常数的表达式为![]() ________。
________。
(2)从开始到平衡C的平均反应速率v(C)=________________。该反应的![]() ________0。(填“
________0。(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)
(3)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在![]() 时刻改变的外界条件是________。
时刻改变的外界条件是________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 之间的关系为_______(用“
之间的关系为_______(用“![]() ”、“
”、“![]() ”或“
”或“![]() ”连接)。
”连接)。
【答案】![]()
![]()
![]() < 升高温度 a
< 升高温度 a ![]()
【解析】
根据图一可知到达平衡时A、B两种物质分别反应了0.3mol、0.6mol,C生成了0.6mol,故该反应的化学方程式为![]() ,从而有:
,从而有:
![]()
起始n/(![]() ) 1 1 0
) 1 1 0
变化n/(![]() ) 0.3 0.6 0.6
) 0.3 0.6 0.6
平衡n/(![]() ) 0.7 0.4 0.6
) 0.7 0.4 0.6
(1)由分析可知该反应的化学方程式为:![]() ;由化学方程式可知,平衡常数的表达式为
;由化学方程式可知,平衡常数的表达式为![]() ;
;
(2)从开始到平衡C的浓度变化为:0.12mol·L-1,时间为3min,故![]() ;由题干达平衡后,降低温度,A的体积分数减小,说明平衡向正反应方向移动,反应放热,故
;由题干达平衡后,降低温度,A的体积分数减小,说明平衡向正反应方向移动,反应放热,故![]() ;
;
(3)①结合图一所得化学方程式及图二,![]() 时刻改变条件后正逆反应速率均增大,故改变的条件可能有升高温度、添加催化剂、增大压强,但
时刻改变条件后正逆反应速率均增大,故改变的条件可能有升高温度、添加催化剂、增大压强,但![]() 平衡向逆反应方向移动,故只能是升高温度;
平衡向逆反应方向移动,故只能是升高温度;
②![]() 为平衡状态,
为平衡状态,![]() 平衡向逆反应方向移动,C的体积分数减小,
平衡向逆反应方向移动,C的体积分数减小,![]() 时刻突变(加入催化剂导致)后,平衡未移动,C的体积分数不变,故C的体积分数最大的是a。
时刻突变(加入催化剂导致)后,平衡未移动,C的体积分数不变,故C的体积分数最大的是a。
③![]() 为平衡状态,达平衡后,降低温度,
为平衡状态,达平衡后,降低温度,![]() 平衡向逆反应方向移动,
平衡向逆反应方向移动,![]() 时刻突变(加入催化剂导致)后,平衡未移动,故
时刻突变(加入催化剂导致)后,平衡未移动,故![]() 。
。


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.过氧化钠的电子式是 Na+[:O:O:]2-Na+
B.原子最外层电子排布式为4s1和5s1 是同一主族元素
C.电负性差值大于 1.7 的化合物一定是离子化合物
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是H2O,配位数是 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是 ( )
A.氯水中存在Cl2+H2O![]() H++Cl-+HClO,当加入AgNO3溶液后,溶液颜色变浅
H++Cl-+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.分别用等体积的蒸馏水和0.010mol/L硫酸洗涤BaSO4沉淀,后者损失的BaSO4沉淀少
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究铁发生电化学腐蚀的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图甲)从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化结果如图,下列叙述错误的是( )
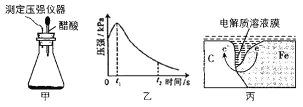
A.图丙中,发生腐蚀时电子转移方向如箭头所示
B.图乙中,t2时容器中压强明显小于起始压强是因为铁粉发生了吸氧腐蚀
C.碳粉表面的电极反应式只有:O2+4e-+2H2O=4OH-
D.若将丙图中的C 换成Zn,铁的腐蚀速率会大大降低,这是是利用了牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的CO气体和CO2气体相比较,下列叙述中正确的是
A.物质的量之比为7:11B.原子数之比为22:21
C.体积之比为1:1D.密度之比为11:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是
A.如图中测定锌粒与l mol/L稀硫酸的反应速率,只需测定注射器中收集氢气的体积
B.如图装置中进行50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液发生中和反应放出热量的测定,使温度计温度升高的热量就是中和反应生成1 mol水的热量
C.如图酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁
D.如图滴定管中液面位置如图所示,则此时的读数为23.65 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是一种短周期元索,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生右下图转化关系.其中R为10电子分子,是一种常见的无机溶剂。下列说法中不正确的是
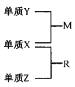
A. X元素位于周期表中第16列
B. X、Y、Z元素两两之间均能形成原子个数比为l:1的化合物
C. X、Y、Z元素形成的单质均具有强还原性
D. R的沸点高于M的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正逆反应速率随时间的变化如图乙所示,下列说法中正确的是( )
2C(g),达到平衡后,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正逆反应速率随时间的变化如图乙所示,下列说法中正确的是( )
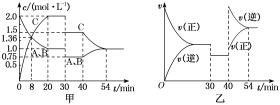
A.30~40 min间该反应使用了催化剂
B.化学方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿![]() 是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
![]() 冶炼铜的反应为
冶炼铜的反应为 若
若![]() 中Fe的化合价为
中Fe的化合价为![]() ,反应中被还原的元素是______
,反应中被还原的元素是______![]() 填元素符号
填元素符号![]() .
.
![]() 冶炼铜的主要流程如图:
冶炼铜的主要流程如图:

![]() 气体A中的大气污染物可选用下列试剂中的______吸收.
气体A中的大气污染物可选用下列试剂中的______吸收.
![]() 浓
浓![]()
![]() 稀
稀![]()
![]() 溶液
溶液
![]() 用稀
用稀![]() 浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为
浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为![]() 的结论.请指出该结论是否合理并说明理由______.
的结论.请指出该结论是否合理并说明理由______.
![]() 冶炼出的铜可以发生下列反应
冶炼出的铜可以发生下列反应![]() 图
图![]()

![]() 写出Cu溶于稀
写出Cu溶于稀![]() 和
和![]() 混合液的离子方程式:______.
混合液的离子方程式:______.
![]() 写出
写出![]() 将Z氧化为
将Z氧化为![]() 的化学方程式:______.
的化学方程式:______.
![]() 对于
对于![]()
![]() 溶液,正确的是______.
溶液,正确的是______.
A、常温下,![]()
B、![]()
C、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com