
(6分) A是一种白色晶体,它与浓氢氧化钠溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B。按下图装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓硫酸反应,放出无色气体C,C在空气中能形成白雾。用圆底烧瓶收集干燥的C,仍按下图装置仪器,挤压滴管的胶头时,可以得到红色喷泉。
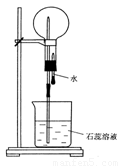
(1)A的化学式是
(2)可用于除去B中水分的干燥剂是 收集气体B的方法是
(3)A与浓氢氧化钠溶液共热生成B的化学方程式
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
 尿素(
尿素(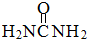 )和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:
)和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省忻州一中高二下学期期中考试文科化学试卷(带解析) 题型:实验题
(6分) A是一种白色晶体,它与浓氢氧化钠溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B。按下图装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓硫酸反应,放出无色气体C,C在空气中能形成白雾。用圆底烧瓶收集干燥的C,仍按下图装置仪器,挤压滴管的胶头时,可以得到红色喷泉。
(1)A的化学式是
(2)可用于除去B中水分的干燥剂是 收集气体B的方法是
(3)A与浓氢氧化钠溶液共热生成B的化学方程式
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省郑州市高三第一次模拟考试化学试卷(解析版) 题型:实验题
无水AlCl3是一种重要的有机合成催化剂,该物质在183℃时升华,遇潮湿空气即产生大量白雾。某中学化学兴趣小组拟利用中学常见仪器设计实验制备无水AlCl3,实验装置如下图所示。

请回答下列问题:
(1)制备实验开始时,先检查装置的气密性,接下来的操作依次是 。
a.加入MnO2粉末 b.点燃A中酒精灯 c.加入浓盐酸 d.点燃D处酒精灯
(2)写出A装置中发生反应的化学方程式: 。
(3)装置B和C中的试剂分别是 。
(4)甲同学认为F和G可以用一种仪器替代,且加入一种药品即可达到相同效果。这种药品可以是 。
(5)E中得到少量白色粉末,打开软木塞后可明显观察到锥形瓶中有白雾生成,用化学方程式表示其原因 。
(6)制备过程中随着盐酸的浓度下降,氯气的制取反应会停止。为测定残余液中盐酸的浓度,某同学量取残余液10.00mL,加水稀释到250.00mL。然后从中取出20.00mL,用0.1000mol·L-1的NaOH标准溶液进行滴定,终点时消耗NaOH溶液24.00mL。则该残余液体中盐酸的浓度为 。
查看答案和解析>>
科目:高中化学 来源:2010年江苏省高二下学期期末考试化学 题型:计算题
(12分) 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)原子序数为22基态钛原子的核外电子排布式为 。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于
晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 。
A. SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42- 稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ,原因是 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ,分子的空间构型为 。
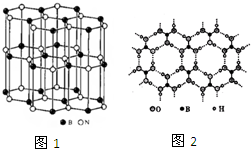
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com