
分析 n(NaOH)=$\frac{100g×8%}{40g/mol}$=0.2mol,如果生成NaHCO3,其质量=0.2mol×84g/mol=16.8g>13.7g,如果生成的盐是碳酸钠,其质量=$\frac{0.2mol}{2}×106g/mol$=10.6g<13.7g,所以生成的盐是碳酸钠和碳酸氢钠的混合物,根据C原子守恒、盐质量进行计算.
解答 解:n(NaOH)=$\frac{100g×8%}{40g/mol}$=0.2mol,如果生成NaHCO3,其质量=0.2mol×84g/mol=16.8g>13.7g,如果生成的盐是碳酸钠,其质量=$\frac{0.2mol}{2}×106g/mol$=10.6g<13.7g,所以生成的盐是碳酸钠和碳酸氢钠的混合物,设碳酸钠、碳酸氢钠的物质的量分别是xmol、ymol,
根据C原子守恒、盐质量进行计算得
$\left\{\begin{array}{l}{2x+y=0.2}\\{106x+84y=13.7}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.05}\\{y=0.1}\end{array}\right.$
根据C原子守恒得n(CO2)=n(NaHCO3)+n(Na2CO3)=0.05mol+0.1mol=0.15mol,
则m(CO2)=0.15mol×44g/mol=6.6g,
答:通过二氧化碳质量为6.6g.
点评 本题考查化学方程式有关计算,为高频考点,正确判断盐成分是解本题关键,再结合原子守恒分析解答,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
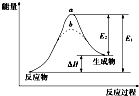
| A. | 逆反应的活化能小于正反应的活化能 | |
| B. | a、b分别对应有催化剂和无催化剂的能量变化 | |
| C. | 该反应的反应热△H=E2-E1 | |
| D. | 催化剂能改变反应的焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| A | B | C | ||
| (1) | 1 | 3 | 0 | 放出热量a kJ |
| (2) | 0 | 0 | 2 | 吸收热量b kJ |
| (3) | 2 | 6 | 0 | 放出热量c kJ |
| A. | A的体积分数:(2)>(1)>(3) | |
| B. | 三个容器内反应的平衡常数:K(3)=K2(1)=K2(2) | |
| C. | 达平衡时体系压强:P(3)=2P(1) | |
| D. | 热量关系:a+b=50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物理变化、化学变化 | B. | 氧化还原反应、分复反应 | ||
| C. | 氧化还原反应、化合反应 | D. | 分解反应、复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL | B. | 40mL | C. | 25mL | D. | 20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g•cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com