
 2SO3(g)是制备硫酸的重要反应。下列有关该反应的叙述中,正确的是
2SO3(g)是制备硫酸的重要反应。下列有关该反应的叙述中,正确的是 A、催化剂V2O5不改变该反应的逆反应速率
B、增大反应体系的压强,反应速率一定增大
C、该反应是放热反应,降低温度将缩短反应达到平衡的时间
D、在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=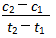
科目:高中化学 来源: 题型:
可逆反应2SO2(g)+O2(g)2SO3(g) ΔH<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是
A.维持温度、反应体系体积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省杭州市西湖高级中学高二5月月考化学试卷(带解析) 题型:单选题
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
| A.通入大量O2 | B.增大容器容积 | C.移去部分SO3 | D.降低体系温度 |
查看答案和解析>>
科目:高中化学 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:填空题
2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
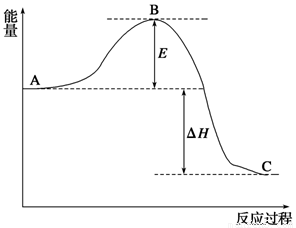
请回答下列问题:
(1)图中A、C分别表示__________、__________,E的大小对该反应的反应热有无影响?____________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___________。
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=____mol/(L·min)
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=_ 。
查看答案和解析>>
科目:高中化学 来源:2014届吉林省吉林市高三开学摸底考试化学试卷(解析版) 题型:填空题
SO2和NOx在化学工业上有重要用途,也是大气污染的主要来源,开发和利用并重,预防和治理并举是当前工业上和环境保护领域研究的主要课题之一。
(1)在接触法制硫酸的过程中,发生2SO2(g)+O2(g)
 2SO3(g)
△H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g)
△H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
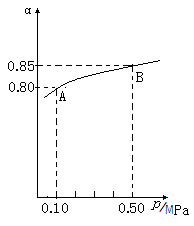
①平衡状态由A到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”);
②将2.0molSO2和1.0molO2置于10L的密闭容器中,若40s后反应达到平衡,此时体系总压强为0.10MPa,这一段时间内SO2的平均反应速率为 。
该反应的平衡常数为 。
(2)用CH4催化还原NOx可消除氮的氧化物的污染,例如:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H=—574kJ·mol—1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H=—1160kJ·mol—1
取标准状况下4.48LCH4并使之完全反应:
①若将NO2还原至N2,整个过程中转移电子的物质的量为 ;
②若还原NO2和NO的混合物,放出的总热量Q的取值范围是 。
查看答案和解析>>
科目:高中化学 来源:2012届河南省驻马店市确山二高高二上学期期中考试化学试卷 题型:选择题
已知反应:2SO2(g)+O2(g)
 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
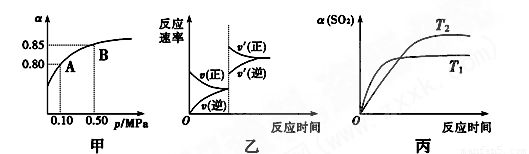
A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com