
下列说法正确的是( )
A.难溶电解质作比较时,Ksp小的,溶解度一定小
B.Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀溶解平衡会发生移动
C.所谓沉淀完全就 是用沉淀剂将溶液中某一离子完全除去
是用沉淀剂将溶液中某一离子完全除去
D.温度一定,当溶液中Ag+和Cl-浓度的乘积等于Ksp时,溶液为AgCl的饱和溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.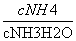 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH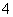 )=c(CH3COO-)
)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
欲将蛋白质从水中析出而又不变性,应加入
A.饱和Na2SO4溶液 B.福尔马林溶液
C.18.4 mol/L的硫酸溶液 D.1.0mol/L的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)  CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达到平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=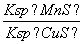
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1的NaHSO4溶液:
c(H+)=c(SO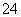 )+c(OH-)
)+c(OH-)
B.含有AgCl和AgI固体的悬浊液:
c(Ag+)>c(Cl-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO )=2c(CO
)=2c(CO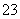 )
)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O )+c(C2O
)+c(C2O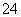 )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO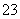 +H2O===Cu(OH)2↓+CO2↑
+H2O===Cu(OH)2↓+CO2↑
次要:Cu2++CO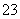 ===CuCO3↓(几乎不发生反应。下同)
===CuCO3↓(几乎不发生反应。下同)
(2)CuSO4+Na2S
主要:Cu2++S2-===CuS↓
次要:Cu2++S2-+2H2O===Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是( )
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
查看答案和解析>>
科目:高中化学 来源: 题型:
以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
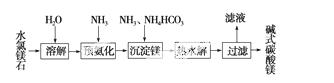
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6 mol·L-1,则溶液中c(Mg2+)=________。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式_______________________
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数________(填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )
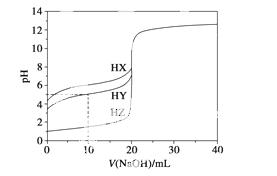
A.在相同温度下,同浓度的三种酸 溶液的导电能力顺序:HZ<HY<HX
溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:
c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时c(H+)=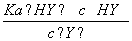 +c(Z-)+c(OH-)
+c(Z-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列行为中符合安全要求的是:
下列行为中符合安全要求的是:
A.在汽车加油站见到的油罐车上贴有如右图的标志
B.节日期间,在开阔的广场燃放烟花爆竹
C.用点燃的火柴在液化气钢瓶口检验是否漏气
D.进入煤矿井时,用火把照明
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com