
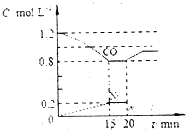
 CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题
CO和NO对环境影响较大,属于当今社会热点问题.请回答下列问题| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
分析 (1)反应焓变△H=反应物键能总和-生成物键能总和;
(2)①依据平衡常数概念和化学方程式计算,结合化学平衡三行计算列式计算平衡浓度,平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②依据加入一氧化碳和氮气的量计算此时浓度商和平衡常数进行比较判断平衡移动方向;
③图象分析一氧化碳浓度增大,说明平衡逆向进行,依据平衡移动原理分析判断选项;
(3)A、化学平衡常数说明反应进行的彻底程度问题,与反应进行的难易程度无关;
B、大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小;
C、合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高;
D、化学平衡常数说明反应进行的彻底程度问题,与反应速率无关.
解答 解:(1)2NO(g)+2CO(g)═N2(g)+2CO2(g)若NO中的键能是632kJ/mol,CO中的键能是1072kJ/mol,CO2中C=O的键的键能为750kJ/mol,N2中的键能是946kJ/mol,则该反应的△H=2×632KJ/mol+2×1072kJ/mol-(946kJ/mol+2×2×750kJ/mol)=-538KJ/mol,
故答案为:-538KJ/mol;
(2)①反应达到平衡状态时,结合三行计算列式,
2NO(g)+2CO(g)═N2(g)+2CO2(g)
起始量(mol/L) 1.4 1.2 0 0
变化量(mol/L) 0.4 0.4 0.2 0.4
平衡量(mol/L) 1 0.8 0.2 0.4
c(CO)=0.8mol/L,C(N2)=0.2mol/L,C(CO2)=0.4mol/L,C(NO)=1mol/L,
k=$\frac{[{N}_{2}][C{O}_{2}]^{2}}{[NO]^{2}[CO]^{2}}$=$\frac{0.{4}^{2}×0.2}{{1}^{2}×0.{8}^{2}}$L•mol-1=0.05 L•mol-1,
故答案为:0.05 L•mol-1;
②加入氮气和一氧化碳的瞬间,C(N2)=(0.2+0.8)mol/L=1mol/L,c(CO)=1.6mol/L,浓度商Qc=$\frac{1×0.{4}^{2}}{1.{6}^{2}×{1}^{2}}$=$\frac{1}{16}$=0.0625>0.05,则平衡向逆反应方向移动;
故答案为:向左;
③平衡时一氧化碳的浓度增大,平衡向逆反应方向移动,
a.缩小容器体积平衡向正反应方向移动,故a错误;
b.增加CO2 的量平衡向逆反应方向移动,故b正确;
c.升高温度平衡向逆反应方向移动,故c正确;
d.加入催化剂不改变平衡移动,故d错误;
故选bc;
(3)A、化学平衡常数说明反应进行的彻底程度问题,与反应进行的难易程度无关,故A错误;
B、化学平衡常数说明反应进行的彻底程度问题,与反应速率无关,故B错误;
C、合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高,反应越完全,故C正确;
D、大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小,没有实际意义,故D正确;
故答案为:CD.
点评 本题考查化学平衡常数及影响因素、意义,依据键能计算反应焓变方法等,难度中等,注意化学平衡常数大小说明反应进行程度,与反应难易无关、与反应速率无关.


科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液能用于腐蚀铜线路板 | B. | 用小苏打治疗胃酸过多 | ||
| C. | 过氧化钠作供氧剂 | D. | 用还原性铁粉作食品抗氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO | ||
| C. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ | D. | Cu(OH)2 $\frac{\underline{\;△\;}}{\;}$CuO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2LSO2和2LCO2 | B. | 9 g水和标准状况下 11.2LCO2 | ||
| C. | 标准状况下1mol氧气和 22.4L水 | D. | 0.1mol氢气和 2.24L氯化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
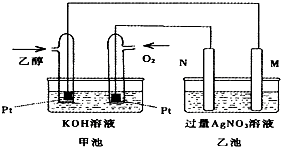
| A. | 若用此装置给铁棒上镀上层银,则N电极改用铁电极,M电极改用银电极 | |
| B. | 甲池中负极的电极反应式为:CH3CH2OH-12e-+3H2O=2CO2+12H+ | |
| C. | 甲池KOH溶液中经过0.05mol电子时,理论上乙池中的M电极质量增加5.04g | |
| D. | M电极上的电极反应式为:Ag++e-=Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com