
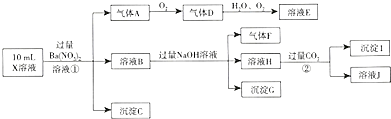
分析 在强酸性溶液中一定不会存在CO32-、SO32-离子;加入过量硝酸钡生成沉淀,则该沉淀为BaSO4,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,则一定为Fe2+离子;溶液B中加入过量NaOH溶液,沉淀G只为Fe(OH)3,生成气体F,则F为NH3,说明溶液中含有NH4+离子;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,以此进行解答.
解答 解:强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续被氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,沉淀G为Fe(OH)3,生成气体F,则F为NH3,说明溶液中含有NH4+离子;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,
(1)根据分析可知,沉淀G为Fe(OH)3,故答案为:Fe(OH)3;
(2)溶液中一定存在的离子为;Al3+、NH4+、Fe2+、SO42-;不能确定的离子为Fe3+和Cl-,
故答案为:Al3+、NH4+、Fe2+、SO42-;Fe3+和Cl-;
(3)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知亚铁离子为0.03mol,根据溶液电中性可知:2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),n(SO42-)=$\frac{2×0.03mol+3×0.01mol+0.01mol+0.04mol}{2}$=0.07mol,
当X溶液中不能确定的离子是Fe3+,则硫酸根离子的物质的量大于0.07mol,生成沉淀C硫酸钡的物质的量大于0.07mol;
当X溶液中不能确定的离子为Cl-,则硫酸根离子的物质的量小于0.07mol,生成沉淀C硫酸钡的物质的量小于0.07mol,
故答案为:>0.07mol;Fe3+;(或<0.07mol;Cl-);
(4)气体A为NO,Fe2+离子被氧化为Fe3+离子,NO3-离子被还原为NO气体,反应①的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(5)H中NaAlO2,沉淀I为氢氧化铝,偏铝酸根离子与二氧化碳反应生成氢氧化铝沉淀,反应②的化学方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(6)500时,将0.3molNH3气体置于某容器为1L的密闭容器中,在一定条件下达到平衡,测得平衡体系中有0.1molNH3,反应消耗了0.2mol氨气,根据反应2NH3?N2+3H2可知,反应生成了0.1mol氮气、0.3mol氢气,反应达到平衡时气体的总物质的量为:0.1mol+0.1mol+0.3mol=0.5mol,容器容积固定,容器内压强与气体的物质的量成正比,则容器平衡时的压强是起始时的$\frac{0.5mol}{0.3mol}$=$\frac{5}{3}$倍;
此时若再向容器中加入0.3mol氨气,反应物浓度增大,则平衡向正反应方向移动;由于与原平衡相比,增大了压强,则最终氨气的转化率减小,
故答案为:$\frac{5}{3}$;减小.
点评 本题考查了常见阴阳离子的检验、无机推断,题目难度中等,注意掌握常见离子的性质及检验方法,(3)为难点、易错点,注意溶液电中性知识在化学计算中的应用方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论或解释 | |
| A | SO2的水溶液导电 | SO2是电解质 |
| B | AlCl3溶液导电 | AlCl3是离子化合物 |
| C | H2SO4溶液导电性比CH3COOH溶液强 | H2SO4是强电解质 |
| D | 0.1mol/LCH3COOH溶液的pH>1 | CH3COOH?H++CH3COO- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通人CaCl2溶液中 | B. | 将H2S气通人到浓硫酸中 | ||
| C. | 将SO2通人Ba(0H)2溶液中. | D. | 氢硫酸长期露置在空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铜和硝酸反应:3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO+7H20,属于氧化还原反应 | |
| B. | Cl2+SO2+2H2O═H2SO4+2HCl属于氧化还原反应 | |
| C. | 4Fe(OH)2+O2+2H2O═4Fe(OH)2属于氧化还原反应和化合反应 | |
| D. | 金属单质与盐溶液的反应都是置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 二氧化碳(CO2)、甲烷(CH3)、水汽(H2O)、臭氧(O3)都是温室气体 | |
| B. | 碘是一种人体必需的微量元素,它被人体吸收后,合成甲状腺激素,但加碘食盐不能使淀粉液变蓝 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 实验室用碳酸钙与水反应,制取乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8gO2和1gH2体积为1:2 | B. | NH3和H2S密度比为1:2 | ||
| C. | 5L N2和4L CH4原子数比为1:2 | D. | 2mol CO2和1mol CO分子数比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com