
在下列反应中,HNO3既表现氧化性,又表现酸性的是( )
A.H2S+2HNO3===S↓+2NO2↑+2H2O
B.CuO+2HNO3===Cu(NO3)2+H2O
C.4HNO3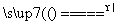 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
D.3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/ kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列两组物质的熔点高低(填“>”或“<”):
SiC Si,Si SiO2。
(2)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)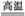 Si(s)+4HCl(g),(已知1 mol Si中含有2 mol Si—Si键)则2 mol H2生成高纯硅需 (填“吸收”或“放出”)能量 kJ。
Si(s)+4HCl(g),(已知1 mol Si中含有2 mol Si—Si键)则2 mol H2生成高纯硅需 (填“吸收”或“放出”)能量 kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
试管中盛有白色晶体,检验它是否是铵盐的方法中不可行的是( )
A.加热,将湿润的红色石蕊试纸放在试管口
B.加氢氧化钠溶液,加热,将湿润的酚酞试纸放在试管口
C.加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在试管口
D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.8 g硫与0.2 mol O2充分反应后的气体总体积在标准状况下为( )
A.1.12 L B.2.24 L
C.3.36 L D.4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对于硝酸的认识,不正确的是( )
A.浓硝酸和稀硝酸都具有氧化性
B.铜与硝酸的反应属于置换反应
C.硝酸可氧化Fe2+
D.常温下可用铁或铝制品盛装浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
某铜粉样品含少量金(Au),不含其他成分。测定该样品中金的含量时,有两种溶解样品的方法:①用稀硝酸溶解样品,②用双氧水和稀盐酸溶解样品,其反应的化学方程式为:Cu+H2O2+2HCl===CuCl2+2H2O。
已知金不与稀硝酸、双氧水和盐酸反应。
(1)写出铜与稀硝酸反应的离子方程式: ____________________________________
__________________。
(2)在铜与双氧水和稀盐酸的反应中氧化剂是________,若有2 mol的H2O2参加反应,则转移电子的物质的量是________。
(3)方法①和②相比较,你认为哪种更好?理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知CO2过量时,CO2与NaOH反应生成NaHCO3(CO2+NaOH=NaHCO3)。参照物质的溶解度,用NaOH(固)、CaCO3(固)、水、盐酸为原料制取33 g纯NaHCO3。
| 25℃ | NaHCO3 | Na2CO3 | NaOH |
| 溶解度/g | 9 | 33 | 110 |
(1)若用100 g水,则制取时需用NaOH g。
(2)若用17.86 g NaOH(固),则需用水 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关亚硫酸的下列叙述中不正确的是( )
A.亚硫酸是SO2的水溶液,显酸性
B.SO3溶于水,剧烈反应生成亚硫酸
C.亚硫酸具有漂白性,能够使品红溶液褪色
D.亚硫酸不稳定,易分解为水和SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)制取金属锌的流程如图所示。
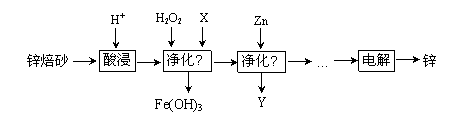

(1)提高酸浸效率的措施为_________________________________(任答一条即可);酸浸时H+与难溶固体ZnFe2O4反应的离子方程式为___________________。
(2)净化Ⅰ中H2O2参与反应的离子方程式为____________________________;X可选择的试剂为______(写化学式)。净化Ⅱ中Y为_____________(写化学式)。
(3)电解法制备锌的装置如图甲所示:
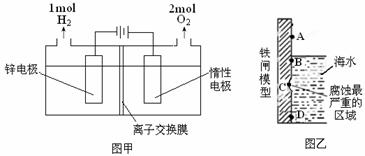
则电解槽中盛有的电解质溶液为______(填字母)。
a.ZnCl2溶液 b.Zn(NO3)2溶液 c.ZnSO4溶液
根据图甲中的数据,可求得电解过程中电流的有效利用率为_________。
(4)使用含有 [Zn(OH)4]2-的强碱性电镀液进行镀锌防腐蚀,可得到细致的光滑镀层,电镀时阴极电极反应式_____________________。以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,图乙中锌块的固定位置最好应在_____处(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com