
工业上将氨气和空气的混合气体通过铂铑合金网发生氨氧化反应,若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为 ( )
A.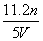 B.
B.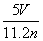 C.
C.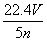 D.
D.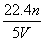
科目:高中化学 来源: 题型:
下列反应中,起到氮的固定作用的是 ( )
A.NH3经催化氧化生成NO B.N2和H2在一定条件下合成NH3
C.NO与O2反应生成NO2 D.由NH3制碳酸氢铵和尿素
查看答案和解析>>
科目:高中化学 来源: 题型:
(NH4)2SO4在一定条件下发生如下反应:4(NH 4)2SO4 =N2↑+6NH3↑+3SO2↑+SO3↑+7H2O;将反应后的混合气体通入BaCl2溶液,产生的沉淀为
4)2SO4 =N2↑+6NH3↑+3SO2↑+SO3↑+7H2O;将反应后的混合气体通入BaCl2溶液,产生的沉淀为
A.BaSO4 B.BaSO3 C.BaS D.BaSO4和BaSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
A.Ba(OH)2 B.H2SO4
C.NaOH D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式。
该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为:
6NO+4NH3—→5N2+6H2O
6NO2+8NH3—→7N2+12H2O
NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g·cm-3。
计算:①该混合气体中NO与NO2的体积比。
②吸收后氨水的物质的量浓度(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
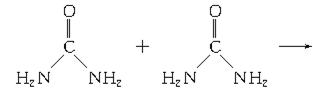
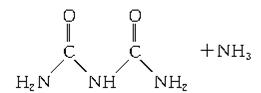
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比。
查看答案和解析>>
科目:高中化学 来源: 题型:
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
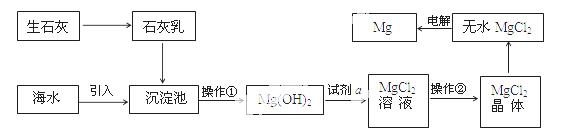
提示:  ①MgCl2晶体的化学式为MgCl2•6H2O;
①MgCl2晶体的化学式为MgCl2•6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是 , 操作②的名称 、 、过滤。
(2)试剂a的名称是 。
(3)用氯化镁电解生产金属镁的化学方程式为: 。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的 方法制金属镁,其原因是 。
方法制金属镁,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于海水的知识不正确的是( )
A.海水资源的利用包括海水水资源利用和化学资源利用
B.海水既苦又涩,不能直接利用
C.海水中某些金属元素总储量很大,但富集程度却很低
D.海水淡化应同化工生产结合,同能源技术结合
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下面有关钠、镁、铝的计算及判断。
(1)取w g钠、镁、铝分别与足量盐酸反应,在相同条件下产生氢气的体积之比是________。
(2)取0.1 mol钠、镁、铝分别与足量盐酸反应,在相同条件下产生氢气的体积之比是________。
(3)若产生相同体积(同温同压)的氢气,所需钠、镁、铝三种金属的物质的量之比是________;质量之比是________。
(4)若将0.2 mol钠、镁、铝分别投入10 mL 1 mol·L-1盐酸中,在标准状况下产生氢气体积的大小顺序是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com