
| A. | 6个碳原子有可能都在一条直线上 | B. | 有5个碳原子可能在一条直线上 | ||
| C. | 6个碳原子一定都在同一平面上 | D. | 6个碳原子不可能在同一平面上 |
分析 分子中含有甲基、C=C、C≡C,结合甲烷为正四面体结构、乙烯为平面型结构、乙炔为直线型结构来解答.
解答 解:分子中碳链空间结构为平面型,如图所示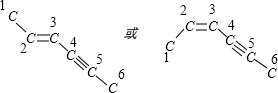 ,乙炔为直线型结构,-C≡C-决定了3、4、5、6号4个碳原子在同一直线上,2、3、4号3个C有键角接近120度,所以6个碳原子不可能都在一条直线上,4个碳原子在一条直线上;
,乙炔为直线型结构,-C≡C-决定了3、4、5、6号4个碳原子在同一直线上,2、3、4号3个C有键角接近120度,所以6个碳原子不可能都在一条直线上,4个碳原子在一条直线上;
乙烯为平面型结构, 决定1、2、3、4号4个碳原子在同一平面内,而3、4、5、6号4个碳原子在同一直线上,3、4号两个C原子已经在平面上,因此这条直线在这个平面上,6个C原子共面,且与C=C、C≡C直接相连的原子在同一平面内,则6个C、还有4个H在同一平面内,所有原子不可能都在同一平面上;
决定1、2、3、4号4个碳原子在同一平面内,而3、4、5、6号4个碳原子在同一直线上,3、4号两个C原子已经在平面上,因此这条直线在这个平面上,6个C原子共面,且与C=C、C≡C直接相连的原子在同一平面内,则6个C、还有4个H在同一平面内,所有原子不可能都在同一平面上;
故选C.
点评 本题主要考查有机化合物的结构特点,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molAl与足量盐酸反应转移电子数为1NA | |
| B. | 标准状况下,22.4L氨气与22.4L氮气所含原子数均为2NA | |
| C. | 7.8gNa2O2所含的离子数为0.3NA | |
| D. | 11.2LCl2完全溶于NaOH溶液,电子转移数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O→H2CO3 | B. | H2+I2→HI | C. | NH3+HCl→NH4Cl | D. | SO2+O2→SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液的pH<7,说明该溶液一定呈酸性 | |
| B. | 常温时pH=3的盐酸溶液与pH=5盐酸溶液等体积混合后溶液的pH=4 | |
| C. | 0.2 mol•L-1的盐酸,与等体积水混合后pH=1 | |
| D. | 常温时pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com