
����Ŀ��ij��ѧ��ȤѧϰС�����ʵ��̽������M��Ũ���ᷴӦ��������
[�������]����1���������ֻ��SO2������2��_______________��
[ʵ�����]Ϊ��̽������M��Ũ���ᷴӦ��������ͼʵ��װ�ã�һ������Ũ���������M��Ӧ��
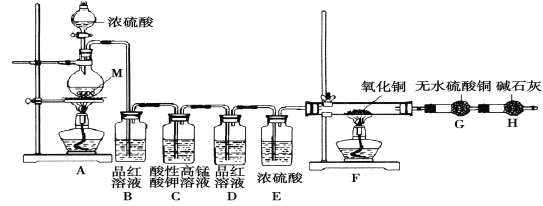
��1�� �������װ�������Ե�һ�ַ����ǣ��رշ�Һ©���Ļ�������Hװ�ú�������һ�����ܣ�Ȼ��_________________________����֤��װ�õ����������á�
��2����Bƿ��Ʒ����Һ��ɫ��E��F��G�ж�����������Ӧ���������н����ԣ�2�ۡ�дA�з�����Ӧ�Ļ�ѧ����ʽ��______________________��
��3��������2��ȷ����ɹ۲쵽��F����_____________��G�������______________��
[ʵ�鷴˼] Ϊ�˽�һ��̽������M�ɷֺ�������֣���������ʵ�飺
��ȡ11��2g����M����װ��A�У�����һ������Ũ���ᣬ��Ӧ������Bƿ��Ʒ����Һ��ɫ������û��ʣ�࣬����G�����أ�G����0��9g��
��4��Ϊ�˹۲���Һ��ɫ��ʵ����Ϻ���Ҫϡ����ƿ����Һ��ϡ����ƿ����Һ�IJ���������________��
��5����ϡ�ͺ����Һ��װ�ס����Թܣ�����Թ���μ�KSCN��Һ����Һ���ɫ�������Թ���μ����Ը��������Һ������Һ��ɫ��ȥ�������ƿ��Һ�н�������Ũ����ȣ�������ɷּ����ʵ���Ϊ__________����д����ƿ�����Ӧ���ܻ�ѧ����ʽ____________________��
���𰸡�����2�����������SO2��H2 �������ܲ���ʢ��ˮ��ˮ���У�����ƿ����������ð���ݣ�ֹͣ������һ��ˮ�������� M��2H2SO4��Ũ��![]() MSO4��SO2����2H2O ��ɫ��ĩ��ɺ�ɫ ��ɫ��ĩ��Ϊ��ɫ �Ƚ���ƿ�л����Һ��ȴ���ٽ����Һ��������ʢˮ���ձ�������Ͻ��� SO2��0��20mol ��H2��0��05mol 4Fe��9H2SO4(Ũ)
MSO4��SO2����2H2O ��ɫ��ĩ��ɺ�ɫ ��ɫ��ĩ��Ϊ��ɫ �Ƚ���ƿ�л����Һ��ȴ���ٽ����Һ��������ʢˮ���ձ�������Ͻ��� SO2��0��20mol ��H2��0��05mol 4Fe��9H2SO4(Ũ) ![]() 2FeSO4��Fe2(SO4)3��4SO2����H2����8H2O
2FeSO4��Fe2(SO4)3��4SO2����H2����8H2O
��������
����������ʱ���ҽ����ϻ��ã������ɵ������п��ܺ������������Լ���2Ϊ�����������SO2��H2��
��1���������װ�������Ե�һ�ַ����ǣ��رշ�Һ©���Ļ�������Hװ�ú�������һ�����ܣ�Ȼ�����ܲ���ʢ��ˮ��ˮ���У�����ƿ����������ð���ݣ�ֹͣ������һ��ˮ����������˵��װ�õ����������á�
��2����Ӧ���������н�����+2�ۣ����ͭ��Ũ����ķ�Ӧ��M��Ũ���ᷴӦ�Ļ�ѧ����ʽΪ��M��2H2SO4(Ũ)![]() MSO4��SO2����2H2O��
MSO4��SO2����2H2O��
��3�����F���к�ɫ��ĩ��ɺ�ɫ��G�а�ɫ����ˮ����ͭ�����ɫ��˵�����������л����������Ӷ�֤������2��ȷ��
��4��Ũ��������ˮ���ȣ���Ũ������ܶȴ���ˮ����˿������ϡ��Ũ����ķ������в���������Ϊ���Ƚ���ƿ�л����Һ��ȴ���ٽ����Һ��������ʢˮ���ձ�������Ͻ��衣
��5������Թ���μ�KSCN��Һ����Һ���ɫ��˵������MΪFe��G����0.9g��0.9gΪˮ�������������������ʵ���Ϊ��n��H2��=n��H2O��=0.9g��18g/mol��0.05mol��1.2g�������ʵ���Ϊ��n(Fe)="11.2g��56g/mol=" 0.2mol�������Թ���μ����Ը��������Һ������Һ��ɫ��ȥ��˵����Һ�к����������ӣ���ƿ��Һ�н�������Ũ����ȣ��������Ӻ��������ӵ����ʵ�����ȣ�n��Fe2+��=n��Fe3+��=0.1mol�����ݵ����غ㣬���ɶ�����������ʵ���Ϊ��n��SO2��=![]() mol��0.20mol������������ᷴӦ�Ļ�ѧ����ʽΪ��4Fe��9H2SO4��Ũ��
mol��0.20mol������������ᷴӦ�Ļ�ѧ����ʽΪ��4Fe��9H2SO4��Ũ��![]() 2FeSO4��Fe2(SO4)3��4SO2����H2����8H2O��
2FeSO4��Fe2(SO4)3��4SO2����H2����8H2O��
�����硿
�������ۺ���ʵ���⣬�ѶȽϴ������й����ʵĻ�ѧ���ʺ�ʵ��ԭ���ǹؼ����ٽ����йؼ���ʱ��Ҫ�����ڸ����غ㷨���������װ�������Լ�����Ҫע�⣺���װ�������Ե�ԭ��һ�㶼��ͨ���ı�װ��������ѹǿʵ�ֵģ�����������Ե�װ�ñ�����һ����������װ�ã����һ��Ҫ������һ���ܱ���ϵ��װ�������Եļ�飬�����������㣺һ�Ƿ������������ֱ�������������ʽ�ǣ�װ���γɷ����ϵ������(�ȡ����桢��ë���桢��ˮ��)�������������ó����ۣ����ȷ����Ĺؼ����Ƿ�ա��ȡ����ݡ�ˮ������Һ��(��)���Ĺؼ����Ƿ�ա�Һ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�־�����Ҫ��;�����壬�ڹ�ҵ�ϴ��������������ᡢ�л��ܼ���ɱ���������ȡ���ͬѧ��ʵ���ҽ����������ʵ��о�
(1)��ͬѧ���ν�����![]() ����ơ���ͭ������������ˮ��Ӧ��ʵ�顣
����ơ���ͭ������������ˮ��Ӧ��ʵ�顣
������Ӧ������������ԭ��Ӧ����___________(�����)��
(2)д����˿��������ȼ�յĻ�ѧ����ʽ��________��
(3)��������ˮ�õ�����Һ��Ϊ��ˮ�����Ƶ���ˮ��_________ɫ�����Ƶ���ˮ�к��е�����Ϊ(ˮ����)________(�ѧʽ)��
(4)��ͬѧ̽�������ܷ���ˮ������Ӧ
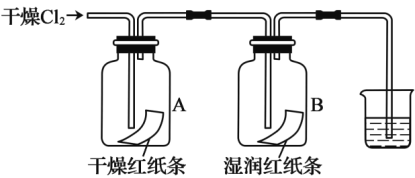
��B��ֽ����ɫ����ϻ�ѧ����ʽ����ԭ��________��
��װ��A��������___________��
���ձ��з�����Ӧ�Ļ�ѧ����ʽΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����dz������ϵ����Ԫ��֮һ���������ڱ���λ�ڵ�6���ڣ�������ͬ��Ԫ�أ�Ԫ�ط�����![]() �����ж��輰�仯��������ʵ��ƶ���ȷ����
�����ж��輰�仯��������ʵ��ƶ���ȷ����
A.![]() �Ľ�����ǿ��
�Ľ�����ǿ��![]()
B.������![]() �۵Ļ�����
�۵Ļ�����
C.�����������ļ��Ա�����
D.![]() ��
��![]() ����������
����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ�������һ�����ڱ�д��������Ȥζʵ�顣��ֽ�����Ȼ��ơ���ɫ��̪�Ļ��Һ��ʪ��Ȼ��ƽ����һ�鲬Ƭ�ϣ���ͨ��Դ����Ǧ������ֽ��д�֣�����ֺ�ɫ�ּ����ݴˣ�����������ȷ���� �� ��
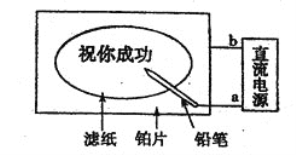
A.Ǧ�ʶ���������������ԭ��Ӧ
B.��Ƭ��������������������Ӧ
C.a���Ǹ�����b��������
D.Ǧ�ʶ�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(��ʽ��ϩ����)��Fe2+�γɵ�������������������ֳ�����Ѫ����������������ȱ����ƶѪ�������Ǻϳɸ���������һ�ֹ���·�ߣ�
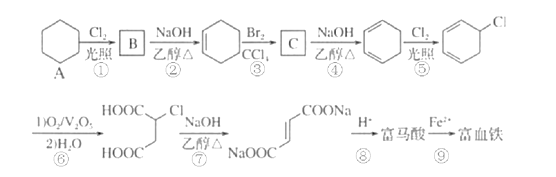
��1��A�Ļ�ѧ����Ϊ___����A����B�ķ�Ӧ����Ϊ__��
��2��C�Ľṹ��ʽΪ___��
��3��д���ۺܵ͢Ļ�ѧ��Ӧ����ʽ��
��Ӧ�ۣ�___��
��Ӧ�ܣ�___��
��4��������ܷ����ķ�Ӧ___��
A.ȡ����Ӧ B.�ӳɷ�Ӧ C.��ȥ��Ӧ D.������Ӧ
��5��������Ϊ��Ԫ���ᣬ1mol����������������NaHCO3��Һ��Ӧ�ɷų�___LCO2���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.�⻯������ͨ�����������2Fe2+��2I����2Cl2��2Fe3+��I2��4Cl��
B.������Һ�е���Ba(OH)2��ҺʹSO42-ǡ����ȫ������2Ba2����3OH����Al3����2SO42-��2BaSO4����Al(OH)3��
C.1molL��1��NaAlO2��Һ��2.5molL��1��HCl��Һ�����������Ȼ�ϣ�2AlO2��+5H+=Al3++Al(OH)3��+H2O
D.��ͭ���缫���CuSO4��Һ��2Cu2����2H2O![]() 2Cu��O2����4H��
2Cu��O2����4H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йع輰�仯�����˵����ȷ���ǣ� ��
A.�մɡ�������ˮ�������������������
B.�����������Σ������ڼ���Թ����ƿ��Ա����ھ���ĥ�ڲ��������Լ�ƿ��
C.��![]() ��ȡ���ᣬӦ��ʹ��������������������Һ��Ӧ��Ȼ����ͨ��
��ȡ���ᣬӦ��ʹ��������������������Һ��Ӧ��Ȼ����ͨ��![]()
D.��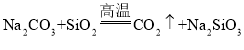 ��֪�����������ǿ��̼��
��֪�����������ǿ��̼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I������������һ�ֽྻ������������Դ����������(��Ҫ�ɷ�ΪCO��CO2��H2��)��H2��ϣ����ϳɼ״��������������õķ���֮һ��
(1)������Ӧ�Ĵ�������Cu��Zn��Al��Ԫ�ء�д����̬Znԭ�ӵ�ԭ�ӽṹʾ��ͼ_____________��
(2)���ݵȵ���ԭ����д��CO���ӵĽṹʽ____________��
(3)�״��������ɵõ���ȩ����ȩ������Cu(OH)2�ļ�����Һ��Ӧ����Cu2O������
�ټ״��ķе�ȼ�ȩ�ĸߣ�����Ҫԭ����______________________________________��
�ڼ�ȩ���ӵĿռ乹����____________________��1 mol��ȩ��������������ĿΪ________��
II����������������HCl����N2����NH3����Na2O2����C2H4����NaOH����Ar
(1)ֻ���ڼ��Լ��ķ�����_________��ֻ�ɷǼ��Լ����ɵķǼ��Է�����________��(����ţ���ͬ)��
(2)���зǼ��Լ������м��Լ����ɵķǼ��Է�����_________��
(3)�������Ӽ������й��ۼ�����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������գ���Ŀǰ����ˮ������������Ҫ����֮һ���乤���������£�

��1���������н������ữ�����Cl2�������ʣ������� ��
��2��������������SO2�Ļ�ԭ�ԣ���Ӧ�����ӷ���ʽΪ ��
��3������������������У��¶�Ӧ������8090�����¶ȹ�����Ͷ������������������ԭ��_______ ��
��4����������������������õ�Һ������ˮ�Ļ������������ǵ�����ܶ����ܴ���ص���з��롣���������������� ��
��5������������֮��δֱ��������Br2�ĺ�ˮ����������õ�Һ�壬���Ǿ�������������������SO2�����������Ȼ��������������������������� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com