
【题目】下列有机物互为同分异构体的是( )
A. 乙烷和乙烯 B. 正丁烷和异丁烷
C. 乙醇和乙酸 D. 葡萄糖和淀粉
科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的流程如下:
![]()
(1)写出②中除烧杯外还要用到的玻璃仪器的名称:_______。
(2)有同学试图利用蒸馏方法来实现第③步操作,该同学设计了如下图蒸馏实验装置,此装置中的明显错误之处为____________ 、______________。

(3)实际操作时,利用蒸馏方法分离I2的CCl4溶液获
得I2的量大 大少于预期,试分析其主要原
因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关碱金属性质的叙述错误的是( )
A.随核电荷数的增加,碱金属的熔、沸点降低
B.随核电荷数的增加,碱金属的密度增大
C.锂在氧气中燃烧生成过氧化锂
D.碱金属与水反应生成碱和氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
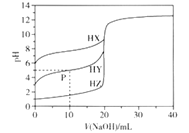
A. 电离常数Ka(HX)的数量级为10-12
B. HX的电离程度大于X-的水解程度
C. pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D. P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:

回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. CO的平衡转化率为80%
C. 通入CO后,正反应速率逐渐增大
D. 反应前H2S物质的量为7 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应。某同学欲利用氯气和单质硼反应制备三氯化硼。已知BC13的沸点为12.5 ℃ ,熔点为-107.3 ℃,遇水剧烈反应,生成硼酸和盐酸。该同学选用下图所示的部分装置(可以重复选用)进行实验,请回答下列问题:
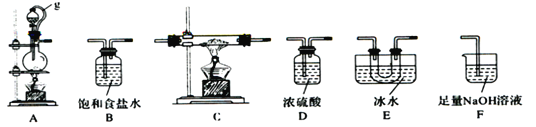
(1)A中反应的离子方程式为__________________。
(2)图中g管的作用是______________________________________。
(3)装置的连接顺序依次为A→ → → →E→D→F;____________在E、F装置间连接D装置的作用是____________________________________________________________。
(4)停止实验时,正确的实验操作是______________________________________________________________________________________________________________。
(5)若硼酸(H3BO3)为一元弱酸,则其钠盐NaH2BO3为_____(填“正盐”或“酸式盐”或“碱式盐”)。
(6)实验完成后,某同学向F中(溶液含有0.05mol/LNaC1O、 0.05mol/LNaCl、0.1mol/LNa0H)滴加品红溶液,发现溶液褪色。现设计实验探究溶液褪色的原因,请在表中空格处填上数据,完成实验方案。
实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O /mL | 品红 溶液 | 现象 |
① | 5.0 | 0 | 0 | x | 4滴 | 较快褪色 |
② | 0 | 5.0 | 5.0 | 0 | 4滴 | 不褪色 |
③ | 5.0 | 0 | 5.0 | 0 | 4滴 | 缓慢褪色 |
则x=_______,结论:________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com