
分析 3Cu+8HNO3(稀)═4H2O+3Cu(NO3)2+2NO↑反应中,3molCu转移6mol电子,消耗8mol硝酸,其中2mol硝酸被还原生成2molNO,据此分析.
解答 解:3Cu+8HNO3(稀)═4H2O+3Cu(NO3)2+2NO↑反应中,3molCu转移6mol电子,消耗8mol硝酸,其中2mol硝酸被还原生成2molNO,
若有1.2mol电子发生转移,则被还原的硝酸为$\frac{1.2mol×2}{6}$=0.4mol,则硝酸的质量为0.4mol×63g/mol=25.2g;
生成的NO为$\frac{1.2mol×2}{6}$=0.4mol,其体积为0.4mol×22.4L/mol=8.96L,
答:被还原的HNO3的质量是25.2g,生成气体在标准状况下的体积是8.96L.
点评 本题考查了有关化学方程式的计算,题目难度不大,注意把握反应中参加反应的硝酸与被还原的硝酸的差别.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 液溴易挥发,应用少量的水液封并放在冷暗处保存 | |
| B. | 硝酸见光易分解、易挥发,应用棕色广口试剂瓶密封保存 | |
| C. | 金属钠遇到氧气和水均立即反应,应保存在煤油中或者液体石蜡里 | |
| D. | 碳酸钠虽然属于盐,但是其水溶液呈碱性,应用带橡胶塞的试剂瓶保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2A是弱酸 | |
| B. | 稀释0.1mol/L H2A溶液,因电离平衡向右移动而导致c(H+)增大 | |
| C. | 在0.1mol/L的H2A溶液中,c(H+)=0.12mol/L | |
| D. | 若0.1mol/L的NaHA溶液中c(H+)=0.02mol/L,则0.1mol/L的H2A溶液中c(H+)<0.12mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
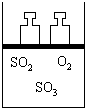 如图所示,将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,试回答:
如图所示,将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
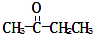 )、丙酸(CH3CH2COOH)和丁二酸(HOOCCH2CH2COOH),试推测此烃的构造式.
)、丙酸(CH3CH2COOH)和丁二酸(HOOCCH2CH2COOH),试推测此烃的构造式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
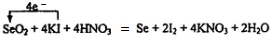 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com