
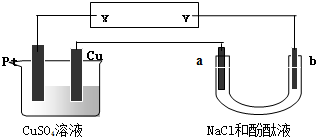
| A、NaCl溶液浓度不变 |
| B、X是负极,Y是正极 |
| C、CuSO4溶液浓度变小 |
| D、X是正极,Y是负极 |
| ||


科目:高中化学 来源: 题型:
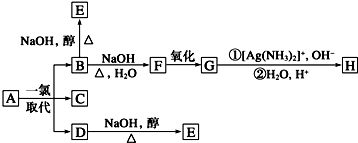
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某物质的水溶液使红色石蕊试纸变蓝,该物质一定是碱 |
| B、某气体能使湿润淀粉碘化钾试纸变蓝,该气体一定是氯气 |
| C、某物质的水溶液中加入盐酸产生无色无味气体,该溶液一定含有碳酸根离子 |
| D、往铁和稀硝酸反应后的溶液中滴入KSCN溶液,溶液显血红色,则该反应后的溶液中肯定有Fe3+,可能还有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用NaOH已经潮解 |
| B、定容时仰视刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、称量时所用砝码生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl |
| B、(NH4)2SO4 |
| C、Ba(OH)2 |
| D、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
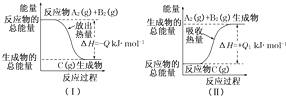
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com